« Small Granules »
« In biology, as in mechanics, one of the best ways to figure out how something works is to break it. »
Gretchen Vogel
La révocation de l’Edit de Nantes par Louis XIV, en 1685, provoqua un exode massif des Huguenots français, dont certains choisirent de s’établir dans les colonies anglaises d’Amérique du nord ; parmi eux se trouvaient les ancêtres maternels de Francis Peyton Rous. A la fin de ses études de médecine à la Johns Hopkins University, le jeune Peyton s’orienta vers la recherche et sollicita l’octroi d’une bourse du Rockefeller Institute for Medical Research. Son directeur, Simon Flexner, avait lu avec intérêt un article de Rous sur les lymphocytes ; il l’invita à rejoindre la prestigieuse institution et à prendre la direction du laboratoire de recherches sur le cancer qu’il venait de quitter.
En 1911, Rous publia un article montrant que de petites quantité de filtrat de sarcome aviaire dépourvu de cellules peut transmettre cette tumeur très métastatique aux espèces sensibles. Loin d’être une tumeur spontanée, comme on le croyait, le sarcome aviaire est causé par un virus. L’importance de cette découverte échappa totalement à la communauté scientifique. Dans les années 1950, il sera établi que le virus du sarcome de Rous est un rétrovirus ; en médecine humaine, ces virus ont une sinistre réputation : ils sont responsables du syndrome d’immunodéficience acquise (SIDA) et de leucémies ; ils ont aussi un comportement qui parut hérétique aux biologistes des années 1950 : ils peuvent, grâce à une ADN polymérase particulière, appelée transcriptase réverse, synthétiser de l’ADN à partir d’une matrice d’ARN, remettant en cause le dogme d’un flux univoque d’information de l’ADN vers l’ARN. Rous fut donc le premier à montrer qu’un virus peut être l’agent causal d’un cancer. Il essaya, sans succès, de cultiver le virus et d’étendre la portée de ses résultats aux tumeurs de la souris. Confronté à la suspicion et aux critiques parfois virulentes de ses confrères, il abandonna, en 1915, ses recherches sur le sarcome. Les années passant, l’importance de la découverte de Rous sur l’agent du sarcome du poulet finit par s’imposer. Après avoir été assailli de critiques, Rous fut couvert de récompenses ; il reçut le prix Nobel de physiologie ou médecine 1966 comme on reçoit l’extrême onction – il avait quatre-vingt-sept ans – « for his pioneering research on the link between viruses and cancer. »
Référence : Rous P A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells (1911). Rous publia son article dans le Journal of Experimental Medicine, une prestigieuse revue créée par le pathologiste William H. Welch, fondateur de la Johns Hopkins School of Medicine et premier président du Board of Scientific Directors du Rockefeller Institute. Rous en deviendra l’éditeur en 1921 et le restera pendant près d’un demi-siècle.
Albert Claude consacra une partie de sa carrière scientifique à purifier le virus de Rous. Sa vocation pour la cancérologie expérimentale est à mettre en relation avec un drame familial vécu dans son enfance, et lié à cette maladie. Ayant quitté l’école à douze ans, il fut d’abord apprenti, puis dessinateur industriel. Il conservera du contact avec les réalités matérielles de l’industrie sidérurgique une aptitude particulière à maîtriser les problèmes techniques de l’instrumentation scientifique. Claude avait agi pendant la Première Guerre mondiale pour le compte du British Intelligence Service ; il fut décoré de la British War Medal, avec citation à l’ordre du jour signée par le Marshall Sir Douglas Haig et par le ministre de la Guerre Sir Winston Churchill. Le gouvernement belge ayant décrété que les anciens combattants pouvaient entrer à l’université sans diplôme ni examen d’entrée, il entreprit en 1922 des études de médecine à l’Université de Liège. Pour sa thèse de doctorat, il choisit comme sujet la greffe hétérologue de cellules cancéreuses chez le rat, travail pour lequel il obtint de J. A. Murray, directeur des Imperial Cancer Research Laboratories à Londres, l’envoi d’une souche du sarcome S-37 de la souris. La qualité de son mémoire lui valut, en 1928, l’octroi d’une bourse de séjour d’un an à l’Université de Berlin. Blumenthal, directeur de l’Institut für Krebsforshung, était un adepte de la théorie bactérienne du cancer et prétendait que la tumeur mammaire de la souris était transmissible par injection de bactéries. Claude montra que le sang injecté aux souris, s’il contenait bien les bactéries suspectées, renfermait aussi des cellules cancéreuses circulantes. Il ne lui restait plus qu’à plier bagages et à chercher un autre laboratoire. Dans celui d’Otto Warburg, au Kaiser Wilhem Institut, il s’initia, au contact d’Albert Fischer, à la culture des tissus et appliqua ses nouvelles connaissances au sarcome S-37. L’engouement pour la culture des cellules et des fragments de tissus était stimulé par l’intérêt des praticiens – Montrose T. Burrows à la Washington University, Alexis Carrel (prix Nobel de Physiologie ou Médecine, en 1912) au Rockefeller Institute for Medical Research – pour les transplantations d’organes. Des fragments de tissus (muscle cardiaque, moelle épinière) ou des cellules isolées étaient placés dans des milieux de survie contenant un cocktail varié de plasma sanguin, d’extraits d’embryon ou de lymphe. Les tissus conservaient leur vitalité. La publication de Ross Granville Harrison (John Hopkins University), eut un grand retentissement : les fibres de neuroblastes de grenouille en culture étaient animées de mouvements.
Référence : Harrison RG Observations on the living developing nerve fiber (1907)
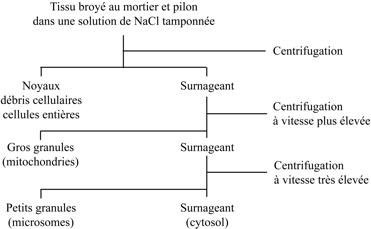
Claude découvrit en 1928 l’article de Peyton Rous sur « l’agent filtrant capable de transmettre le sarcome du poulet ». Enthousiasmé par sa lecture, il rédigea un projet de recherche visant à isoler le virus et l’envoya à Simon Flexner, directeur du Rockefeller Institute, responsable du Laboratory for Cancer Research, et éditeur du réputé Journal of Experimental Medecine. Il faut rendre hommage à l’ouverture d’esprit de Flexner qui accepta le projet d’un parfait inconnu et lui octroya un poste (assez mal rétribué) d’assistant volontaire. En 1929, Claude rejoignit le laboratoire de de James Murphy (Department of Pathology), un élève de Peyton Rous qui avait repris en 1920 le flambeau abandonné par son maître en 1915. Claude entreprit en 1930 le laborieux travail d’isolement de « l’agent filtrable causant le sarcome du poulet ». En 1936, il entendit parler des travaux de William E. Gye (National Institute for Medical Research, Hampstead) sur les sarcomes aviaires et l’emploi de la centrifugation pour en isoler les agents filtrables. Encore étudiant en médecine, Claude avait déjà eu recours à la centrifugation (avec une centrifugeuse de table actionnée à la main) pour isoler « les beaux granules rouge orangé des leucocytes éosinophiles » présents dans les tissus cancéreux et les expectorations des malades. Il prépara, un broyat d’embryons de poulets infectés par « l’agent I de la tumeur des poulets » ; il essaya plusieurs milieux d’homogénéisation : eau distillée, solution de chlorure de sodium, tampon phosphate de pH voisin de la neutralité. Il soumit le broyat à des centrifugations à vitesses croissantes.
La centrifugation dite différentielle sépare les particules essentiellement en fonction de leur taille. La rotation du rotor de la centrifugeuse génère une force centrifuge qui déplace les particules à une vitesse qui dépend de leur volume et, dans une moindre mesure, de leur densité. Les vitesses de déplacement sont calculées en utilisant l’équation de Theodor Svedberg (prix Nobel de chimie 1926). Pour déterminer les vitesses de rotation du rotor, Claude fit une estimation de la taille des organites à séparer, principalement les noyaux et les mitochondries. Il obtint ainsi un culot à basse vitesse contenant des noyaux et des cellules intactes ou partiellement broyées ; un culot à moyenne vitesse (« Large Granules ») formé de mitochondries ; un culot à haute vitesse (« Small granules » ou « Particles ») renfermant les virus qu’il cherchait à séparer. Ce culot avait un contenu élevé en « ribose nucleoprotein complexes » – le génome du virus de Rous est un ARN – et avait conservé un pouvoir infectieux : remis en suspension et injecté à des poulets ce culot transmettait le sarcome. L’expérience « contrôle » réservait une surprise : le culot de Small granules obtenu à partir d’embryons non infectés était dépourvu de pouvoir infectieux, comme on pouvait s’y attendre, mais il était gélatineux et riche en ARN ! Quelle était sa nature ? S’agissait-il d’un nouvel organite subcellulaire ? Claude publia ces résultats en 1938 ; un autre article, publié en 1947 avec Keith R. Porter et Edward G. Pickels, contenait une micrographie électronique montrant les amas de particules virales dans le cytoplasme de cellules infectées.
Claude consacra ses efforts à l’identification de l’organite riche en ARN présent dans les Small Granules. Il crut d’abord qu’il s’agissait de fragments de mitochondries, mais il acquit rapidement la certitude qu’il s’agissait d’un organite non encore identifié. Était-il spécifique des cellules d’embryon de poulet ? Était-il présent dans toutes les cellules eucaryotes ? Claude fractionna des tissus normaux et cancéreux, des tissus animaux et végétaux et des cellules de levure ; chaque fois, il obtint le même culot gélatineux, transparent, ambré, riche en phospholipides et renfermant jusqu’à 85% de l’ARN total du broyat. Au début des années 1940, les connaissances sur le contenu en organites de la cellule étaient limitées ; dans un article de 1943, Claude énumérait la liste des composants répertoriés par les cytologistes : noyau, mitochondries, appareil de Golgi, substance fondamentale et sarcode de Dujardin ! Pour caractériser le nouveau composant, il fallait « remonter » des Small particles (rebaptisées « microsomes », en 1943) à l’organite dans son contexte cellulaire, c’est-à-dire, suivre la démarche inverse de celle suivie par ses prédécesseurs – Friedrich Miescher, Martin Behrens, Robert Bensley – lorsqu’ils cherchaient à isoler un organite préalablement observé au microscope : le noyau, pour Miescher, les mitochondries dans le cas de Behrens ou de Bensley. Claude mit au point le fractionnement subcellulaire quantitatif en s’inspirant de l’approche des chimistes pour établir la composition d’un mélange de substances : les constituants chimiques (ARN, phospholipides, azote protéique) et enzymatiques furent mesurés dans l’homogénat et dans toutes les fractions, de façon à établir un bilan comparatif en pourcentage du contenu de l’homogénat. Claude publia en 1946 sa technique et sa « philosophie » du fractionnement.
Dans le même laboratoire que Claude (Department of Pathology, Rockefeller Institute), Walter Schneider s’intéressait à la localisation intracellulaire des enzymes respiratoires ; il avait montré que la cytochrome oxydase et la succinoxydase sédimentent dans la fraction des gros granules. L’examen microscopique de cette fraction révélait la présence de mitochondries sous forme de granules sphériques. L’eau et les solutions salines utilisées comme milieux d’homogénéisation provoquaient l’agglutination des organites. Il fallait trouver un milieu respectant la forme allongée caractéristique des mitochondries dans les cellules examinées au microscope. Les deux George, Hogeboom et Palade, qui avaient rejoint le groupe de Claude en 1941 et 1946 respectivement, allaient s’en charger. Hogeboom avait étudié la médecine et la chimie à Washington University. Sa motivation dans le choix d’une carrière scientifique n’était pas sans rappeler celle de Claude : le père d’Hogeboom était mort des suites d’un cancer. Pendant son séjour dans le laboratoire de Robert Chambers (New York University), George Palade, médecin et anatomiste, fut attiré vers la microscopie électronique après avoir assisté à une conférence de Claude, un pionnier de cette nouvelle technologie. Hogeboom, Schneider et Palade comparèrent les mérites respectifs de quatre milieux d’homogénéisation sur la morphologie et la colorabilité des mitochondries : solution de NaCl à 85%, eau distillée, saccharose 250 millimolaire (mM) ou 880 mM. C’est dans ce dernier milieu que les mitochondries étaient les mieux préservées. Finalement, c’est le saccharose 250 mM qui sera retenu comme milieu d’homogénéisation. Le broyage des tissus au mortier fut remplacé par l’usage de l’homogénéiseur de Potter et Elvejhem.
En 1949, Claude quitta New York pour Bruxelles, où il prit la direction de l’Institut Jules Bordet. La caractérisation du composant riche en ARN restait en chantier. L’hypothèse mitochondries étant devenue très improbable, une nouvelle piste fut explorée : l’origine des Small Granules serait le « lace-like reticulum », récemment découvert au microscope électronique. La dispersion du Rockefeller Group se poursuivit avec le départ de George Hogeboom pour les National Institutes of Health à Bethesda, où il étudia avec Walter Schneider la distribution subcellulaire de nombreux enzymes. Il disparut en 1956, à quarante-trois ans, en pleine maturité scientifique, après avoir créé le concept d’« enzyme marqueur » (d’un organite) qui allait permettre l’interprétation des résultats du fractionnement subcellulaire.
Références : Ledingham JCG, Gye WE On the Nature of the Filterable Tumour-Exciting Agent in Avian Sarcomata (1935)
Claude A A Fraction from Normal Chick Embryo Similar to the Tumor-Producing Fraction of Chicken Tumor I (1938)
Claude A, Porter KR, Pickels EG Electron Microscope Study of Chicken Tumor Cells (1947)
Claude A The constitution of protoplasm (1943)
Claude A Fractionation of mammalian liver cells by differential centrifugation: I. Problems, methods and preparation of extract (1946)
Claude A Fractionation of mammalian liver cells by differential centrifugation: II. Experimental procedures and results (1946)
Hogeboom G, Schneider WC, Palade GE Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material (1946)
« Lace-like reticulum »
« Our function is not to provide confirmatory morphological evidence for old concepts, but to define a new morphological background against which old and new physiological data will be interpreted in the future. »
George E. Palade
La commercialisation des microscopes électroniques en transmission Siemens et AEG (Allgemeine Elektricitäts-Gesellschaft) débuta en 1939 ; le microscope RCA (Radio Corporation America) fut mis sur le marché américain en 1941 ; celui de la firme Philips fut distribué en Europe en 1943. Un industriel new-yorkais, Albert Gessler, ayant eu connaissance des difficultés rencontrées par Claude pour identifier un virus provoquant un cancer, mit à sa disposition le microscope RCA EMB récemment acquis par le département de recherches d’Interchemical Laboratory, et l’aide d’Ernest F. Fullam pour apprendre à l’utiliser. Claude et Fullam examinèrent d’abord une préparation de mitochondries de lymphosarcome de rat, des organites dont l’observation au microscope optique avait révélé la morphologie. Ils s’associèrent ensuite à Keith Porter pour examiner une cellule entière. Porter avait mis au point une méthode de déshydratation des cellules animales en culture (l’examen au microscope électronique s’effectue sous vide). La micrographie d’un fibroblaste de poulet étalé sur une grille métallique et fixé dans les vapeurs d’acide osmique révélait la présence au sein de la substance fondamentale de la cellule d’un vaste réseau de membranes (« lace-like » reticulum) formé de chapelets de corps vésiculaires (vesicle-like bodies). Cette découverte amena plusieurs groupes de chercheurs, parmi lesquels Keith Porter et Helen P. Thompson (Rockefeller Institute for Medical Research), Albert J. Dalton (National Cancer Institute, Bethesda), Wilhelm Bernhard et Charles Oberling (Institut du Cancer du Centre National de la recherche scientifique, Villejuif), à s’intéresser à l’étude de la substance fondamentale des cellules.
Références : Claude A, Fullam EF An electron microscope study of isolated mitochondria (1945)
Porter KR, Claude A, Fullam EF A Study of Tissue Culture Cells by Electron Microscopy : Methods and Preliminary Observations. (1945)
La première micrographie électronique d’une cellule ne permettait de voir le détail des structures intracellulaires que sur le bord le plus mince de la préparation mais pas dans la région plus épaisse entourant le noyau. Le recours aux coupes de tissus s’imposait. Keith Porter, au Rockefeller Institute, et Fritiof S. Sjöstrand, au Karolinska Institutet, à Stockholm, mirent au point des techniques d’inclusion des tissus et de microtomie. Parmi les milieux de fixation des tissus qui furent proposés : tétraoxyde d’osmium (Keith Porter et Frances L. Kallman), permanganate de potassium et acroléine (John H. Luft, Department of Anatomy, Harvard Medical School), formaldéhyde (F. Blum), George Palade porta son choix sur le tétroxyde d’osmium, un oxydant puissant qui, en interagissant avec les acides gras des phospholipides rend les membranes cellulaires opaques aux électrons ; elles apparaissent sous forme de lignes noires sur fond clair. L’acidité provoquant la formation d’artefacts dans les tissus, Palade dilua l’acide osmique dans le tampon acétate/véronal de Michaelis (pH 7,2 à 7,6). Le « milieu de Palade », mis au point en 1952, fut universellement adopté. En 1961, David Sabatini introduisit la glutaraldéhyde, qui présente l’avantage de préserver l’activité des enzymes ; de plus, ce milieu pénètre mieux dans les tissus que l’acide osmique et permet de fixer des échantillons volumineux. Pour l’inclusion des échantillons, Newman et coll. proposèrent un milieu à base de méthyl ou de butyl méthacrylate, qui se solidifient par dessiccation au four. Le méthacrylate s’étant révélé instable sous un faisceau d’électrons, il fut remplacé en 1956 par les résines époxy. Pour couper les échantillons inclus dans un milieu solide, Ernest Fullam, chez Interchemical Laboratory, avait conçu un microtome. Keith Porter et Joseph Blum, dans l’atelier du Rockefeller Institute, ajoutèrent un mécanisme d’avance du couteau, préservant la surface du bloc à couper, et un réservoir de liquide pour recueillir les coupes par flottaison, afin d’éviter qu’elles ne se recroquevillent avant d’être déposées sur une grille métallique. Le microtome « Porter-Blum » fut achevé dans les années 1950 et largement adopté dans les laboratoires de microscopie électronique. Harrisson Latta et J. Francis Hartmann (Department of Biology, Massachusetts Institute of Technology, Cambridge) utilisèrent des couteaux de verre, bientôt remplacés par des couteaux en diamant, plus chers mais beaucoup plus résistants. Avec des coupes de 20 à 40 nm d’épaisseur, on pouvait atteindre une résolution inférieure à une dizaine de nm.
Références : Porter K, Kallman F The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy (1953)
Luft JH Permanganate—a new fixative for electron microscopy (1956)
Luft JH The use of acrolein as a fixative for light and electron microscopy (1959)
Luft JH Improvements in epoxy resin embedding methods (1961)
Newman SB, Borysko E, Swerdlow M New sectioning techniques for light and electron microscopy (1949)
Porter KR, Blum J A study in microtomy for electron microscopy (1953)
Sjostrand FS A new microtome for ultrathin sectioning for high resolution electron microscopy (1953)
Latta H, Hartmann JF Use of a Glass Edge in Thin Sectioning for Electron Microscopy (1950)
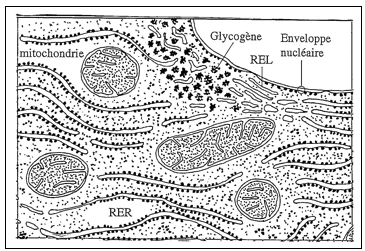 |
| Reticulum endoplasmique d’une cellule hépatique. RER : reticulum endoplasmique rugueux ; REL reticulum endoplasmiqur lisse. |
Keith Porter et Frances L. Kallman montrèrent que les éléments du réseau membranaire cytoplasmique sont en continuité entre eux formant ainsi un organite unique. Cet organite polymorphe (saccules, tubules, vésicules) a tendance à se fragmenter en vésicules au cours de l’homogénéisation des tissus. Dès 1948, Claude avait émis l’hypothèse que les microsomes dérivent du réseau membranaire cytoplasmique. Le lien fut établi par George Palade ; il proposa que l’homogénéisation provoque la formation des vésicules microsomiales par pincement de la membrane du réticulum (pinching off process). D’un diamètre moyen de 130 nm, les vésicules microsomiales sont lisses (sans ribosomes liés) ou rugueuses (avec des ribosomes liés). Fait remarquable, elles conservent l’architecture du réticulum endoplasmique, dont la membrane sépare le cytoplasme d’un espace interne appelé « lumen » ou, plus rarement, « réticuloplasme ». La face externe des vésicules correspond à la face cytoplasmique de la membrane ; le contenu vésiculaire correspond au réticuloplasme et les ribosomes restent liés à la face externe des vésicules microsomiales rugueuses. J. Francis Hartman et Michael L. Watson montrèrent que la membrane du reticulum est en continuité avec la membrane externe de l’enveloppe nucléaire. A cette occasion, apparut pour la première fois l’appellation « reticulum endoplasmique ». Fritiof Sjöstrand et V. Hanzon (Department of Anatomy, Karolinska Institutet, Stockholm) complétèrent la description du réseau membranaire cytoplasmique par celle des tubules et des citernes de l’appareil de Golgi.
Références : Porter K, Kallman FL Significance of Cell particulates as seen by electron microscopy (1952)
Palade GE, Siekevitz P Liver microsomes; an integrated morphological and biochemical study (1956)
Sjöstrand FS, Hanzon V Ultrastructure of Golgi apparatus of exocrine cells of mouse pancreas (1954)
Jean L. Brachet (Université libre de Bruxelles) et Torbjörn O. Casperson (Karolinska Institutet) découvrirent, indépendamment, le rôle de l’ARN dans la synthèse des protéines ; les cellules où cette synthèse est très active sont riches en ARN. Albert Claude avait montré qu’une grande proportion de l’ARN de la cellule se retrouve dans les microsomes ; leur implication dans la synthèse protéique fut établie par Henry Borsook (California Institute of Technology) et par Tore Hultin (Wenner-Gren Institute for Experimental Biology, Stockholm). A la fin des années 1940, des traceurs radioactifs (14C, 3H, 32P, 35S) furent mis à la disposition des biochimistes. Paul C. Zamecnik et coll. (Huntington Laboratories of Harvard University, Massachusetts General Hospital, Boston) montrèrent que chez des rats auxquels ils avaient injecté des acides aminés radioactifs, la radioactivité est associée aux microsomes. Cyrus P. Barnum et Robert A. Huseby (National Institute of Health, Bethesda), et Mary L. Petermann (Sloan Kettering Institute, New York) obtinrent par centrifugation à haute vitesse d’un surnageant post-microsomial des particules impliquées dans la synthèse protéique ; les « ultra microsomes » de Barnum et les « macromolécules de ribonucléoprotéine » de Peterman étaient plus petits que les vésicules microsomiales et avaient un rapport ARN/protéine plus élevé. En 1953, Palade observa au microscope électronique des grains opaques aux électrons dans le cytoplasme des cellules ; il les appela « Small Particulate Components », ou « Ribonucleoprotein Particles ». Longtemps appelés « grains de Palade », ces particules furent rebaptisés « ribosomes » par Howard M. Dintzis (Department of Biology, Massachusetts Institute of Technology) et par J.M. Robertson, en 1958.
Références : Brachet J La localisation des acides pentosenucléiques dans les tissus animaux et les oeufs d’Amphibiens en voie de développement (1942)
Borsook H, Deasy CL, Haagen-Smit AJ, Keighley G, Lowy PH The uptake in vitro of 14C-labelled glycine, L-leucine, and L-lysine by different components of guinea pig liver homogenate (1950). Henry Borsook travaillait dans le Département de biologie fondé par Thomas H. Morgan au California Institute of Technology, à Pasadena.
Littlefield JW, Keller EB, Gross J, Zamecnik PC Studies on cytoplasmic ribonucleoprotein particles from the liver of the rat (1955)
Barnum CP, Huseby RA Some quantitative analyses of the particulate fractions from mouse liver cytoplasm (1948)
Petermann ML, Hamilton MG An ultracentrifugal analysis of the macromolecular particles of normal and leukemic mouse spleen (1952)
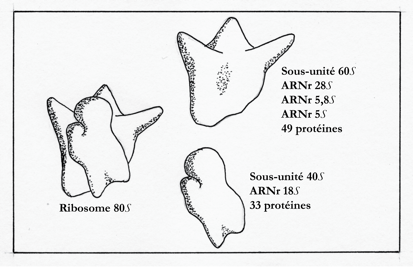
Alfred Tissières et James Watson (Harvard) montrèrent que le ribosome d’Escherichia Coli est dissociable en deux entités, une grande et une petite, composées chacune de protéines et d’ARN. Au terme d’un impressionnant travail d’analyse, Masayasu Nomura et ses associés (Laboratory of Genetics, University of Wisconsin, Madison) établirent la composition en ARN et en polypeptides de ces sous-unités ribosomiales. Dans les solutions salines concentrées, les sous-unités se dissocient en ARNr et protéines ; il suffit de ramener progressivement le taux de salinité à une valeur voisine de celui du cytosol, pour que l’ARNr et les polypeptides s’associent spontanément en ribosomes. Chez Escherichia Coli, la petite sous-unité 30S est constituée de l’ARNr 16S et de 21 protéines ; la grande sous-unité 50S, des ARNr 5S et 23S et de 33 protéines. Chez les eucaryotes, la grande sous-unité 60S renferme les ARNr 28S, 5,8S et 5S et 49 protéines ; la petite sous-unité 40S est constituée de l’ARNr 18S et de 33 protéines. La petite sous-unité contient le site de lecture de l’ARNm ; la grande sous-unité, possède le site catalytique où se fait la liaison peptidique (Peptidyl-transferase center). Walter Gilbert (Harvard University, prix Nobel de chimie 1980), co-découvreur de l’ARNt avec Mahlon Hoagland, montra que les peptides néo-synthétisés sont liés à la grosse sous-unité ribosomiale, et que l’association des ribosomes en polysomes augmente considérablement la vitesse de lecture de l’ARNm et de synthèse des polypeptides. Dans les cellules tumorales en culture, où le taux de division est élevé, l’ARNr peut représenter jusqu’à 80% de l’ARN total des cellules ; les 20% restant sont des ARN de transfert (ARNt), des ARN messagers (ARNm), des ribonucléoprotéines non ribosomiales et des ARN divers. Un progrès majeur dans l’étude de la synthèse protéique fut accompli, au début des années 1950, avec la mise au point d’un système acellulaire constitué d’un surnageant de foie de rat additionné d’acides aminés, d’ATP et d’une mixture régénérant l’ATP. Dans le laboratoire de Zamecnik, la quantité de peptides synthétisés in vitro était très faible. K. Mc Qillen obtint, en 1960, des résultats plus convaincants avec des ribosomes d’Escherichia coli incubés en présence d’acides aminés radioactifs.
Références : Tissières A, Watson JD Ribonucleoprotein particles from Escherichia Coli (1958)
Hosokawa K, Fujimura RK, Nomura M Reconstitution of functionally active ribosomes from inactive subparticles and proteins (1966)
Palade GE A small particulate component of the cytoplasm (1955)
Un exploit scientifique :
la structure cristallographique du ribosome
Dans les années 1980, deux groupes de chercheurs entreprirent le fastidieux travail consistant à obtenir des cristaux de ribosomes et de sous-unités ribosomiales. A cette époque, la possibilité d’établir par cristallographie aux rayons X la structure de machines moléculaires aussi volumineuses (des dizaines de milliers d’atomes) suscitait un scepticisme quasi général. Les groupes d’Alexander S. Spirin (Université d’État Lomonosov, Moscou) et d’Ada E. Yonath (Weizmann Institute of Science, Rehovot) se lancèrent néanmoins dans la préparation de cristaux de qualité suffisante pour l’analyse cristallographique. Ils choisirent comme matériel expérimental des ribosomes de bactéries résistantes aux températures élevées (thermophilie) (Bacillus stearothermophilus, Thermus thermophilus), aux milieux de salinité élevée (halophilie) (Haloarcula morismortui, Halobacterirum marismortui), ou aux radiations ionisantes (Deinococcus radiodurans), plus susceptibles de résister aux conditions dénaturantes de l’analyse aux rayons X que ceux d’Escherichia coli, par exemple. Avec l’inestimable soutient de Heinz-Günter Wittmann (Max-Planck-Institut für Molekulare Genetik, Berlin-Dahlem), Yonath vit sa persévérance récompensée ; au fil des années, elle obtint des cristaux diffractant à des résolutions toujours plus élevées : 15 à 18 Å (1984), 6 Å (1987), 4,5 Å (1999), 3,1 Å (2001). La voie de l’analyse cristallographique des ribosomes et de leurs sous-unités était ouverte. Utilisant les méthodes mises au point dans les laboratoires de Spirin et de Yonath, plusieurs groupes s’y engouffrèrent, parmi lesquels ceux de Thomas A. Steitz et Peter B. Moore (Howard Hughes Medical Institute, Yale University) et de Venkatraman Ramakrishnan (Medical Research Council Laboratory of Molecular Biology, Cambridge). Steitz et Moore résolurent la structure cristallographique de la sous-unité 50S à 9 Å (1998) puis à 5 Å (1999) et 2,4 Å (2000). Préalablement, Moore avait utilisé la diffusion des neutrons aux petits angles (Small-angle neutron scattering) pour faire une cartographie tridimensionnelle des 21 protéines de la petite sous-unité du ribosome d’Escherichia coli. Ramakrishnan élucida la structure de la sous-unité 30S à 5,5 Å (1999) puis à 3 Å (2000). Connaître la structure atomique des ribosomes est d’un intérêt considérable, non seulement en biologie fondamentale mais aussi en thérapeutique : les ribosomes bactériens sont la cible de la majorité des antibiotiques utilisés en médecine humaine et animale. Ramakrishnan, Steitz et Yonath partagèrent le prix Nobel de Chimie 2009.
Références : Marvin Friedman S Protein-synthesizing Machinery of Thermophilic Bacteria (1968)
Yonath A, Miissig J, Tesche H, Lorenz S, Erdmann VA, Wittmann HG Characterization of crystals of small ribosomal subunits (1980)
Yonath A, Saper MA, Frolow F, Makowski I, Whittmann HG Characterization of single crystals of the large ribosomal particles from a mutant of Bacillus stearothermophilus (1986)
Makowski I, Frolow F, Saper MA, Shoam M, Whittmann HG, Yonath A Single crystals of large ribosomal particles from Halobacterium marismortui diffract to 6 Å (1987)
Glotz C, Müssig J, Gewitz HS, Makowski I, Arad T, Yonath A, Whittmann HG Three-dimensional crystals of ribosomes and their subunits from eu- and archabacteria (1987)
Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A Structure of functionally activated small ribosomal subunit at 3.3 Å resolution. Cell (2000)
Yusupov MM, Trakhanov SD, Barinin VV et al. Crystallization of 30S subunits of ribosome of Thermus thermophilus (1987)
Trakhanov SD, Yusupov MM, Agaralov SC, Garber MB et al Crystallization of 70S ribosomes and 30S ribosomal subunits from Thermus thermophilus (1987)
Yusupov MM, Tischenko SV, Trakhanov SD, Ryazantsev SN, Garber MB A new crystallin form of 30S ribosomal subunits from Thermus thermophilus (1988)
Yusupov MM, Garber MB, Vasiliev VD, Spirin AS. Thermus thermophilus ribosomes for crystallographic studies (1991)
Capel MS, Moore PB Quaternary structure of the small ribosomal subunit of Escherichia Coli determined by neutron diffraction (1988)
Ban N, Freeborn B, Nissen P, Penczek P, Grassucci RA, Sweet R, Frank J, Moore PB, Steitz TA A 9 Å resolution X-ray crystallographic map of the large ribosomal subunit (1998)
Ban N, Nissen P, Hansen J, Moore PB, Steitz TA The complete atomic structure of the large ribosomal subunit at 2.4 Å resolution (2000)
Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V Structure of the 30S ribosomal subunit (2000)
Reticulum endoplasmique et synthèse protéique
La synthèse protéique débute dans le cytosol par l’association de l’ARNm et de la petite sous-unité ribosomiale. Masayasu Nomura (Institute for Enzyme Research at the University of Wisconsin) montra que cette première étape est immédiatement suivie de l’ancrage de la grosse sous-unité, aboutissant ainsi à la formation d’un ribosome fonctionnel. C’est la phase d’initiation. Avec la traduction de l’ARNm par le ribosome, commence l’élongation du polypeptide. La lecture codon par codon des instructions portées par l’ARNm entraîne la sélection d’un acide aminé qui s’ajoute à la chaîne peptidique naissante. La peptidyl-transférase ribosomiale catalyse le transfert de la chaîne peptidique sur l’acide aminé choisi (lié à son ARNt spécifique sous forme d’aminoacyl ARNt). La terminaison de la traduction a lieu lorsque le déplacement du ribosome sur l’ARNm l’amène devant le codon stop, indiquant la fin du message traduit. L’ARNm se détache et le ribosome se dissocie en sous-unités. Raymond O.R. Kaempfer, Matthew S. Meselson et Heschel J. Raskas (The Biological Laboratories, Harvard University, Cambridge) ont décrit le cycle d’association des sous-unités en ribosomes fonctionnels, et de dissociation des ribosomes en sous-unités. Pour différencier les ribosomes « anciens » des ribosomes et sous-unités nouvellement synthétisés, ils firent croître Escherichia coli dans un milieu contenant les isotopes « lourds » 13C du carbone, 15N de l’azote et 3H de l’hydrogène. Les bactéries renfermant les ribosomes 70S « lourds » marqués au 13C, 15N et 3H furent transférées dans un milieu de culture sans isotopes et incubées le temps nécessaire à la synthèse de nouveaux ribosomes. Après broyage des cellules, la centrifugation en gradient de densité permit de séparer trois bandes distinctes : une bande dense de ribosomes lourds (13C, 15N, 3H), une bande de densité intermédiaire de ribosomes dont seule la grosse (50S), ou la petite (30S) sous-unité étaient marquées, et une bande « légère » de ribosomes 70S.
Référence : Kaempfer ROR, Meselson MS, Raskas HJ Cyclic dissociation into stable subunits and re-formation of ribosomes during bacterial growth (1968)
La synthèse protéique est un processus centralisé : en 1972, Michael Rosbash (Department of Biology, Massachusetts Institute of Technology, Cambridge, prix Nobel de physiologie ou médecine 2017) montra que la traduction débute toujours sur les polysomes cytosoliques ; elle se poursuit dans le cytosol pour les protéines « domestiques » cytosoliques, nucléaires, nucléolaires et peroxysomiales, pour certaines protéines mitochondriales ou chloroplastiques ; elle se poursuit sur les polysomes liés au réticulum endoplasmique (reticulum endoplasmique rugueux) pour les protéines membranaires du reticulum, du complexe de Golgi, des lysosomes, de la membrane plasmique, et pour les protéines sécrétoires stockées dans les granules de sécrétion et exportées hors de la cellule. Le site où une protéine exerce sa fonction est donc généralement différent du site de synthèse, ce qui implique un transport de protéines entre les deux sites. Les cellules qui fabriquent de grandes quantités de protéines sécrétoires (cellules pancréatiques, hépatocytes, plasmocytes, fibroblastes) possèdent un réticulum endoplasmique rugueux développé. Les cellules des procaryotes ou les réticulocytes (les globules rouges du sang), qui fabriquent essentiellement des protéines « domestiques », sont dépourvues de système endomembranaire ; leurs ribosomes sont libres dans le milieu intracellulaire.
Référence : Rosbash M Formation of membrane-bound polyribosomes (1972)
Après la découverte des microsomes par Albert Claude et la caractérisation morphologique du reticulum endoplasmique par Keith Porter et George Palade, celui-ci et ses collaborateurs entreprirent une série de travaux pour élucider la fonction de cet organite dans la cellule. Palade choisit comme matériel expérimental les cellules des acini pancréatiques (chez le cobaye). Le pancréas est une glande annexe du tube digestif, formée de tissu endocrine (les îlots de Langherans) et de tissu exocrine, constitué d’acinis de cinq à dix cellules qui synthétisent et exportent des enzymes digérant les acides nucléiques (DNAse, RNAse), les protéines (trypsinogène, chymotrypsinogène, procaboxy-peptidases, élastase), les lipides (lipase, phospholipase A2) et les hydrates de carbone (amylase). Il existe un parallèle entre l’activité sécrétoire élevée du pancréas, la présence, dans les cellules acineuses d’un reticulum endoplasmique particulièrement bien développé, et de nombreux granules de sécrétion (grains de zymogènes) ; ils s’accumulent au pôle apical avant de déverser leur contenu en enzymes dans des canalicules aboutissant au canal pancréatique (canal de Wirsung) et à la portion antérieure de l’intestin grêle (duodénum).
Philip Siekevitz rejoignit en 1954 le laboratoire de Palade et y introduisit la technique de synthèse protéique in vitro apprise dans le laboratoire de Paul Zamecnik (Huntington Laboratories, Harvard University, Massachusetts General Hospital), un pionnier des travaux dans ce domaine. Palade et Siekevitz élucidèrent le rôle des « grains de Palade » (ribosomes) présents dans le cytoplasme des hépatocytes et des cellules acineuses, en combinant, fractionnement subcellulaire, examen au microscope électronique et biochimie. Au cours de ces travaux, Palade imagina le mécanisme de « pinching off » pour expliquer comment la fragmentation du reticulum endoplasmique au cours du broyage des tissus, aboutit à la formation des vésicules microsomiales ; la présence de « ribonucléoprotéines » (ribosomes) à leur surface des microsomes rugueux prouve qu’elles ont conservé la même polarité que l’organite. Palade et Siekevitz montrèrent aussi que les microsomes rugueux sont le site de synthèse des enzymes pancréatiques. L’approche expérimentale consistait à injecter des acides aminés marqués puis à détecter le marquage dans les fractions subcellulaires.
Références : Palade GE, Siekevitz P Liver microsomes: an integrated morphological and biochemical study (1956)
Palade GE, Siekevitz P Pancreatic microsomes: an integrated morphological and biochemical study (1956)
Siekevitz P, Palade GE A cyto-chemical study on the pancreas of the guinea pig. III. In vivo incorporation of leucine-1-C14 into the proteins of cell fractions (1958)
Siekevitz P, Palade GE A cytochemical study on the pancreas of the guinea pig. IV. Chemical and metabolic investigation of the ribonucleoprotein particles (1959)
Siekevitz P, Palade GE A cytochemical study on the pancreas of the guinea pig. 5. In vivo incorporation of leucine-1-C14 into the chymotrypsinogen of various cell fractions (1960)
Pour suivre le sort des protéines sécrétoires dans les cellules acineuses pancréatiques – synthèse, transport intracellulaire, stockage dans des granules, décharge – Lucien Caro et Palade utilisèrent deux techniques expérimentales : le radiomarquage suivi de chasse (pulse chase experiment) et la microscopie optique ou électronique combinée à la radio-autoradiographie ; le marquage des protéines à la 3H-leucine se retrouve dans le reticulum endoplasmique rugueux (après 5 minutes), puis dans le Golgi (20 minutes) et les grains de zymogène (60 minutes). Comment se fait le transport des protéines néo-synthétisées entre ces compartiments cellulaires ? Pour tester l’hypothèse d’un transport par des vésicules localisées à la périphérie du Golgi, James Jamieson et Palade ont analysé la cinétique du transport des protéines pancréatiques néo-synthétisées en reprenant l’approche expérimentale de Caro : marquage avec de la 14C-leucine suivi d’incubation dans un milieu de chasse (pulse chase) pendant 7, 17 et 57 minutes ; fractionnement subcellulaire des tranches de tissus incubées par centrifugation en gradient de densité pour isoler les microsomes lisses (renfermant les éléments du Golgi) et microsomes rugueux. Ces expériences mirent en évidence l’existence d’une voie sécrétoire.
Références : Caro LG, Palade GE Protein synthesis, storage and discharge in the pancreatic exocrine cell. An autoradiographic study (1964)
Jamieson JD, Palade GE Role of the Golgi complex in the intracellular transport of secretory proteins (1966)
Jamieson JD, Palade GE Intracellular transport of secretory proteins in the pancreatic acinar cell. I. Role of the peripheral elements of the Golgi complex (1967)
Jamieson JD, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. I. Role of the peripheral elements of the Golgi complex (1967)
Jamieson JG, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. II. Transport to Condensing Vacuoles and Zymogen Granules (1967)
Parallèlement à ces travaux, David Sabatini menait, dans le laboratoire de Palade, des études sur les ribosomes liés à la membrane du reticulum endoplasmique. En 1966, Sabatini, Colin Redman et Günter Blobel comparèrent l’efficacité de divers solutions pour détacher les ribosomes des microsomes rugueux : chlorure de potassium, pyrophosphate de sodium, éthylène diamine tétra-acétate (EDTA). Ces solutés déplacent ou « chélatent » le Mg2+, un cation dont la présence est nécessaire à l’ancrage du ribosome à la membrane. Le coefficient de sédimentation des particules détachées est mesuré par centrifugation zonale dans une centrifugeuse analytique. Le lavage par une solution d’EDTA détache d’abord la petite sous-unité (+/- 32 S) ; en augmentant progressivement la concentration en EDTA, on détache les grosses sous-unités (+/- 47 S) surtout si l’on fait suivre le lavage à l’EDTA par un traitement par le désoxycholate. Même dans ces conditions, une certaine proportion de grosses sous-unités restent fixées à la membrane. Après incubation en présence de 3H-leucine, le marquage est majoritairement associé aux grosses sous-unités résistantes à l’EDTA. Les ribosomes sont liés à la membrane du réticulum endoplasmique par leur grosse sous-unité ; l’ion Mg2+ joue un rôle dans cette liaison.
La puromycine est un antibiotique dont la formule chimique comporte principalement une adénosine liée à une tyrosine diméthylée ; la structure de cet antibiotique rappelle celle de l’extrémité 3’ d’un aminoacyl ARNt ; il se fixe sur le site P du ribosome. La chaîne peptidique naissante, transférée sur le site P, se lie à la puromycine. La phase d’élongation avorte et le polypeptide lié à la puromycine se détache du ribosome. Sabatini montra que l’addition de puromycine à une solution de chlorure de potassium détache la quasi-totalité des ribosomes liés à la membrane. Le peptide naissant, détaché prématurément du ribosome et lié à la puromycine, est déchargé dans la lumière du reticulum endoplasmique. La chaîne polypeptidique naissante participe à la liaison du ribosome à la membrane. La décharge vectorielle du polypeptide dans le lumen se fait probablement par un canal transmembranaire qui pourrait être en continuité avec celui qui traverse la grosse sous-unité et qui fut observé en 1966 au microscopie électronique, après coloration négative, par David Sabatini, Yutaka Tashiro et George Palade.
Référence : Sabatini DD, Tashiro Y, Palade GE On the attachment of ribosomes to microsomal membranes (1966)
David D. Sabatini et Günter Blobel (Rockefeller University, New York) montrèrent que dans un système de synthèse protéique in vitro, en présence de microsomes rugueux, l’extrémité amino-terminale des polypeptides naissants est protégée contre une hydrolyse protéolytique par la trypsine ou la chymotrypsine ; la grosse sous-unité ribosomiale et la chaîne polypeptidique naissante sont en contact étroit avec la membrane ; l’extrémité amino-terminale du polypeptide participerait à la liaison du ribosome à la membrane. Deux résultats ont conduit à se poser une série de questions : (i) il y a dans le cytoplasme deux pools de ribosomes ; (ii) ce ne sont pas les mêmes ARNm qui sont traduits par les ribosomes libres ou par les ribosomes liés à la membrane ; (iii) on n’a pas détecté de différence de composition entre ribosomes libres et ribosomes liés à la membrane ; il n’y a qu’une seule population de ribosomes Quels sont les fonctions respectives des ribosomes des deux pools ? Comment se fait le choix entre la synthèse protéique par les ribosomes liés plutôt que par les ribosomes cytosoliques ? Comment un polypeptide dont la séquence primaire comporte majoritairement des acides aminés hydrophiles traverse-t-il la bicouche phospholipidique hydrophobe de la membrane ?
Références : Blobel G Sabatini DD Controlled proteolysis of nascent polypeptides in rat liver cell fractions. I. Location of the polypeptides within ribosomes (1970)
Sabatini DD Blobel G Controlled proteolysis of nascent polypeptides in rat liver cell fractions. II. Location of the polypeptides in rough microsomes (1970)
Dans un article publié en 1971 dans le volume 2 de la série Biomembranes, éditée par Lionel A. Manson, Blobel et Sabatini formulèrent l’hypothèse que le choix du ribosome est dicté par une séquence de codons présente à l’extrémité 5’ des ARNm traduits par le reticulum endoplasmique rugueux, mais absente chez les ARNm traduits par les ribosomes libres. Les modalités de cette première version de l’hypothèse du signal (Signal Hypothesis) furent complétées par Blobel, en 1975 et dans les années suivantes, : à l’extrémité N-terminale des protéines sécrétoires, un peptide d’une trentaine d’acides aminés, essentiellement hydrophobes, se fixe à la membrane du reticulum endoplasmique. Ce peptide émergeant de la grosse sous-unité ribosomiale, est reconnu par un récepteur qui dirige l’ensemble vers la membrane L’existence du peptide signal est transitoire ; il est retiré au cours de la décharge vectorielle du polypeptide naissant.
Il existe une grande diversité de tailles et de compositions parmi les séquences signal N-terminales ; elles comportent en moyenne 15 à 25 résidus d’acides aminés, parfois jusqu’à 50 ou plus. Elles comportent une région riche en acides aminés hydrophobes (leucine, isoleucine, alanine, phénylalanine, valine, tryptophane, tyrosine), encadrée par une région amino-terminale et une région carboxy-terminale contenant le site de clivage de la peptidase du signal.
Références : Blobel G, Sabatini DD Ribosome-Membrane Interaction in Eukaryotic Cells (1971)
Blobel G, Dobberstein B Transfer of proteins across membranes. I. Presence of proteolytically processed and unprocessed nascent immunoglobulin light chains on membrane-bound ribosomes of murine myeloma (1975)
Blobel G, Walter P, Chang CN, Goldman BM, Erikson AH, Lingappa VR Proteolytic Processing of Signal Peptides (1979)
Blobel G Intracellular protein topogenesis (1980)
Le bien fondé de l’hypothèse du signal reçut une première confirmation avec la publication, en 1972, de l’article de Cesar Milstein (Department of Biochemistry, Cambridge University) – l’inventeur avec Georges Köhler des anticorps monoclonaux. Il rapporta que la chaîne légère d’immunoglobuline IgG synthétisée in vitro dans un système acellulaire était plus longue que la chaîne « normale »; la différence de taille correspondait à un peptide de 2,3 kilodaltons. En présence de microsomes ajoutés au système acellulaire la protéine synthétisée avait la taille normale. Milstein formula l’hypothèse que l’immunoglobuline était synthétisée sous forme d’un précurseur plus long que la chaîne légère et qu’avant d’être sécrétée par le plasmocyte, la séquence additionnelle était excisée par une peptidase présente dans les microsomes. Les résultats de Milstein, et leur interprétation suscitèrent d’abord le doute : le peptide additionnel était un artefact des systèmes acellulaires de synthèse protéique (lysat de réticulocytes de lapin, extrait de germes de blé). Ils furent rapidement confirmés par les résultats du généticien Philip Leder (Laboratory for Molecular Genetics, National Institute of Health, Bethesda), de Susumi Tonegawa et Maria Irene Baldi (Basel Institute for Immunology) et d’Israel Schechter. D’autres données, de nature génétique, vinrent à l’appui de l’hypothèse du signal. L’invertase, un enzyme de la muqueuse intestinale qui catalyse l’hydrolyse du saccharose, existe sous deux isoformes : une forme cytoplasmique et une forme sécrétée. Les deux ont la même séquence primaire, mais le gène codant pour la forme sécrétée possède un exon supplémentaire spécifiant un peptide amino-terminal. L’immunoglobuline M possède une isoforme membranaire et une isoforme sécrétée portant un peptide signal amino-terminal. Le gène codant l’isoforme membranaire possède une séquence codant un peptide signal et un exon supplémentaire spécifiant la séquence hydrophobe d’un peptide transmembranaire à l’extrémité carboxy-terminale de l’immunoglobuline M.
Références : Milstein C, Brownlee GG, Harrison TM, Mathews MB A Possible Precursor of Immunoglobulin Light Chains (1972)
Tonegawa S, Baldi I Electrophoretically Homogeneous Myeloma Light Chain mRNA and its Transcription in vitro (1973)
Schechter I, Burstein Y Marked hydrophobicity of the NH2-terminal extra piece of immunoglobulin light-chain precursors: possible physiological functions of the extra piece (1976)
Pour poursuivre l’étude du mode d’accostage des ribosomes sur la membrane du reticulum endoplasmique, et de la translocation co-traductionnelle du polypeptide néo-synthétisé, il fallait mettre au point un système acellulaire combinant synthèse protéique et translocation. Pour le système de synthèse protéique in vitro, on eut recours à un lysat de réticulocytes de lapin programmé par de l’ARNm de myélome de la souris : le produit de traduction est plus long que la chaîne légère d’immunoglobuline sécrétée. La mise au point d’un système de translocation co-traductionnelle du polypeptide naissant fut plus laborieuse ; l’addition de microsomes au milieu de traduction inhibait la synthèse protéique. Gunter Blobel et Bernhard Dobberstein (The Rockefeller University, New York) découvrirent, après de longs tâtonnements, que les microsomes de pancréas de chien n’exercent pas cet effet inhibiteur sur un système de synthèse protéique in vitro programmé par de l’ARNm de chaîne légère d’IG. En présence de microsomes, le produit de synthèse avait la taille de l’immunoglobuline sécrétée ; il était déchargé à l’intérieur des vésicules, comme le montrait son inaccessibilité aux protéases ajoutées dans le milieu. La différence de taille entre les immunoglobulines synthétisées en absence ou en présence de microsomes correspondait à un peptide d’une vingtaine d’acides aminés à l’extrémité amino-terminale. Les résultats du séquençage indiquèrent que la partie centrale du peptide était majoritairement constituée d’acides aminés hydrophobes.
Référence : Blobel G, Dobberstein B Transfer of proteins across membranes. II. Reconstitution of functional rough microsomes from heterologous components (1975)
Dans leur publication de 1971, Sabatini et Blobel avaient accompagné l’exposé de leur hypothèse par une illustration montrant la reconnaissance par un « facteur » de la séquence amino-terminale du polypeptide néo-synthétisé et toujours lié au ribosome : « This binding factor could be a soluble protein » ; il fut isolé à la fin des années 1970. Dans un système in vitro couplant synthèse protéique et décharge co-traductionnelle du polypeptide, la capacité de translocation des microsomes est abolie par deux types de traitement: le lavage par une solution saline ou par une attaque protéolytique. En 1978, Graham Warren et Bernhard Dobberstein (European Molecular Biology Laboratory) montrèrent que la capacité de translocation de microsomes lavés peut être restorée par un facteur présent dans l’extrait salin ; il fut identifié en 1980 par Peter Walter et Günter Blobel (The Rockefeller Institute) et baptisé « Particule de reconnaissance du signal » (Signal Recognition Particle, SRP) en 1981. Chez les eucaryotes, cette machine moléculaire de forme allongée contient 6 polypeptides (72, 68, 54, 19, 14 et 9 kDa) avec un site de fixation du GTP, et un ARN de 300 nucléotides (coefficient de sédimentation 7S). La SRP est abondante dans le cytoplasme et son importance physiologique est attestée par le degré de conservation élevé de l’ARN 7S, des Archéobactéries à l’homme. Ce petit acide ribonucléique contient en effet une information essentielle au fonctionnement de la ribonucléoprotéine. Chez les bactéries, dépourvues de reticulum endoplasmique, la particule se compose d’un ARN 4,5S et d’une protéine homologue de la protéine de 54 kDa. Peter Walter montra que le rôle de la SRP est de reconnaître le peptide signal dès qu’il émerge de la grosse sous-unité ribosomiale. Le peptide en cours de synthèse est alors formé d’environ 70 résidus d’acides aminés, dont 40 sont séquestrés dans le ribosome. Ajouté à un système de synthèse protéique à base de germe de blé, programmé par un ARNm, l’addition de SRP ralentit significativement la vitesse d’élongation d’un peptide sécrétoire mais pas de protéines cytosoliques, comme les chaînes α et β de la globine. L’inhibition est levée par addition de microsomes lavés par une solution saline mais n’est pas levée par des microsomes ayant subi une attaque protéolytique. On a montré que la SRP ralentit la vitesse d’élongation d’un peptide en cours de synthèse en bloquant le site ribosomial de fixation des facteurs d’élongation eF1 et eF2.
Références : Warren G, Dobberstein B Protein transfer across microsomal membranes reassembled from separated membrane components (1978)
Walter P, Blobel G Translocation of proteins across the endoplasmic reticulum II, Signal recognition protein (SRP) mediates the selective binding to microsomal membrane of in-vitro-assembled polysomes synthesizing secretory proteins (1981)
Walter P, Blobel G Disassembly and reconstitution of signal recognition particle (1983)
La poursuite de l’élongation impliquait la levée du blocage par un facteur que l’on supposait associé au reticulum endoplasmique ; il fut isolé en 1982 par David Meyer et Bernhard Dobberstein (European Molecular Biology Laboratory) par protéolyse ménagée de microsomes rugueux en présence d’une concentration saline élevée. C’est un hétérodimère constitué d’une sous-unité α, à la face cytosolique du reticulum, et d’une sous-unité β insérée dans la membrane. La sous-unité α est une GTPase. Le mode d’interaction entre les facteurs de l’extrait protéolytique et de l’extrait salin fut élucidé par Reid Gilmore et Günter Blobel (The Rockefeller University). Le premier, baptisé docking protein, est le récepteur de la SRP. L’interaction SRP – récepteur de la SRP permet l’accostage sélectif sur le reticulum endoplasmique du complexe ribosome – peptide signal – SRP. C’est l’étape cruciale de la translocation co-traductionnelle des protéines à travers la membrane ; elle est sous la dépendance de l’hydrolyse de molécules de GTP liées à la sous-unité α du récepteur et à la SRP:
L’hydrolyse de GTP provoque un changement de conformation qui entraîne le détachement de la SRP du peptide signal et du ribosome. La séquence signal traverse la membrane ce qui la met à l’abri d’une attaque par des protéases cytosoliques. Le blocage de l’élongation cesse et la synthèse du polypeptide reprend sur le ribosome lié à la membrane.
Références : Meyer DI, Dobberstein B Identification and characterization of a membrane component essential for the translocation of nascent proteins across the membrane of the endoplasmic reticulum (1980)
Meyer DI, Dobberstein B A membrane component essential for vectorial translocation of nascent proteins across the membrane of the endoplasmic reticulum: requirements for its extraction and reassociation with the membrane (1980)
Walter P, Blobel G Purification of a membrane-associated protein complex required for protein translocation across the endoplasmic reticulum (1980)
Gilmore R, Blobel G, Walter P Protein translocation across the endoplasmic reticulum. I. Detection in the microsomal membrane of a receptor for the signal recognition particle (1982)
Gilmore R, Walter P, Blobel G Protein translocation across the endoplasmic reticulum. II. Isolation and characterization of the signal recognition particle receptor (1982)
Meyer DI, Krause E, Dobberstein B Secretory protein translocation across membranes-the role of the “docking protein” (1982)
Günter Blobel et R. C. Jackson ont solubilisé la peptidase du signal de pancréas de chien, en traitant les microsomes rugueux avec du désoxycholate de sodium. En incubant cet extrait avec les précurseurs de la prolactine et de l’hormone de croissance, synthétisés dans un extrait de germe de blé, la taille des précurseurs est réduite à celle des hormones matures. Dans un test post-traductionnel, Jackson mit en contact l’extrait avec le précurseur de la prolactine ; le produit d’incubation a la même taille que l’hormone mature et les résultats d’un séquençage partiel indiquent que l’extrémité amino-terminale est la même que celle de l’hormone. Les microsomes rugueux sont inactifs sur le précurseur. La peptidase du signal est localisée à l’intérieur des vésicules, c’est-à-dire dans le lumen du reticulum endoplasmique.
Références : Jackson RC, Blobel G Post-translational processing of full-length presecretory proteins with canine pancreatic signal peptidase (1980)
Evans EA, Gilmore R, Blobel G Purification of microsomal signal peptidase as a complex (1986)
Le complexe de la peptidase du signal a été purifié à partir de microsomes de pancréas de chien par Emily A. Evans et Reid Gilmore dans le laboratoire de Günter Blobel. Le résultat de l’analyse par électrophorèse sur gel de polyacrylamide révèle qu’il est constitué de six polypeptides (quatre chez la levure) de masses moléculaires 25, 23, 22, 21, 18, and 12 kDa, dont certains sont glycosylés (23 et 22 kDa). L’ensemble est intégré dans la membrane du reticulum endoplasmique. Un seul polypeptide, inséré dans la membrane par son extrémité amino-terminale et dont l’essentiel émerge dans le lumen, porte le site actif (endopeptidase) ; il clive le peptide signal dès son émergence du translocon. La peptidase du signal (leader peptidase) existe aussi chez les bactéries ; celle d’Escherichia coli a été caractérisée par C. Zwinsinski et William Wickner (Department of Biological Chemistry, University of California, Los Angeles). Il existe deux peptidases du signal : la peptidase I, dont le gène lep a été séquencé par Paul B. Wolfes et coll., et la peptidase II codée par le gène lsp.
Références : Zwinsinski C, Wickner W Purification and characterization of leader (signal) peptidase from Escherichia coli (1980)
Wolfe PB, Wickner W, Goodman JM Sequence of the Leader Peptidase Gene of Escherichia coli and the Orientation of Leader Peptidase in the Bacterial Envelope (1983)
Domenica Borghese, dans le laboratoire de David D. Sabatini (Department of Cell Biology New York University School of Medicine), a montré que l’on peut fixer des ribosomes in vitro, en l’absence de synthèse protéique, sur des microsomes rugueux, préalablement dégranulés. Les sites spécifiques fixant les ribosomes ne sont pas présents dans la membrane des microsomes lisses ou celle des globules rouges. Les sites de fixation des ribosomes in vitro ont des constantes apparentes d’affinité élevées : elles ont été mesurées avec en incubant des 3H-ribosomes 80 S, préparés à partir de cellules (cellules hématopoïétiques HPC, cellules du myélome 456) cultivées en présence de 3H-uridine, avec des vésicules rugueuses dont les ribosomes ont été détachés par traitement avec des chélateurs dans un milieu de force ionique élevée (KCl 700 mM).
Références : Borghese D, Mok W, Kreibich G, Sabatini DD Ribosomal-membrane interaction: in vitro binding of ribosomes to microsomal membranes (1974)
Davis JL, Morris RO The affinity of rat liver ribosome subunits for degranulated rough microsomal membranes (1976)
Le traitement de microsomes rugueux de foie de rat par le détergent non-ionique Kyro EOB élimine la majorité des protéines présentes dans la préparation ; deux protéines restent attachées aux polysomes liés à la membrane. Elles sont fusionnées aux polysomes après traitement de microsomes rugueux par un agent liant. Elles se déplacent latéralement en même temps que les ribosomes, et se retrouvent avec eux dans des « vésicules inversées », obtenues en traitant des microsomes rugueux par du Triton-X-100 à faible concentration.
Ces deux glycoprotéines transmembranaires sont présentes dans les microsomes rugueux de tissus sécrétoires de plusieurs espèces animales. Croyant avoir affaire aux sites de fixation des ribosomes sur la membrane du reticulum endoplasmique, Gert Kriebich et coll. les ont baptisées: ribophorine I (MW 65,000) et ribophorine II (MW 63,000). Leur véritable fonction fut découverte lorsqu’on a isolé le complexe de l’oligosaccharyl-transférase, et établi sa composition en polypeptides.
Références : Kreibich G, Czako-Graham M, Grebenau W, Mok W, Rodriguez-Boulan E, Sabatini DD Characterization of the ribosomal binding sites in rat liver rough microsomes: ribophorins I and II, two integral membrane proteins to ribosome binding (1978)
Kreibich G, Freienstein B, Pereyra BN, Ulrich BL, Sabatini DD Proteins of rough microsomal membranes related to ribosome binding. II. Crosslinking of bound ribosomes to specific membrane proteins exposed at the binding sites (1978)
Kreibich G, Ojakian G, Rodriguez-Boulan E, Sabatini DD Recovery of ribophorins and ribosomes in “inverted rough” vesicles derived from rat liver rough microsomes (1982)
Amar-Costesec A, Todd JA, Kreibich G Segregation of the Polypeptide Translocation Apparatus to Regions of the Endoplasmic Reticulum Containing Ribophorins and Ribosomes. I. Functional Tests in Rat Liver Microsomal Subfractions (1984)
William J. Lennarz et coll (Department of Physiological Chemistry, The John Hopkins University School of Medicine, Baltimore) ont montré que la glycosylation des protéines par la voie des intermédiaires lipidiques est localisée dans les microsomes rugueux d’oviducte de poulet et pas dans les microsomes lisses. Une partie des réactions de cette voie sont sensibles à une digestion protéolytique des vésicules : ces réactions se déroulent sur la face cytoplasmique de la membrane du reticulum endoplasmique, tandis que le transfert de l’oligosaccharide su le polypeptide, insensible aux protéases, a lieu sur la face luminale. Lennarz et coll. ont proposé un modèle regroupant l’ensemble de ces réactions en un complexe multienzymatique transmembranaire. Les données récentes sur l’oligosaccharyl-transférase ont confirmé la validité de ce modèle : avant son transfert sur le polypeptide en cours de synthèse, la chaîne glycanique est portée par un lipide membranaire, le dolichol pyrophosphate, localisé sur la face cytoplasmique de la membrane.
Références : Czichi U, Lennarz WJ Localization of the enzyme system for glycosylation of proteins via the lipid-linked pathway in rough endoplasmic reticulum (1977)
Hannover JA, Lennarz WJ N-Linked glycoprotein assembly. Evidence that oligosaccharide attachment occurs within the lumen of the endoplasmic reticulum (1980)
Hanover JA, Lennarz WJ Transmembrane Assembly of N-linked Glycoproteins. Studies on the topology of saccharide-lipid synthesis (1982)
La dolichyl diphospho-oligosaccharyl-transférase est le complexe enzymatique responsable de la N-glycosylation co-traductionnelle des polypeptides synthétisés par les ribosomes liés à la membrane du reticulum endoplasmique. Elle a été caractérisée pour la première fois à partir de pancréas de chien,en 1992, dans le laboratoire de Reid Gilmore (University of Massachusetts Medical School). Le complexe est formé de quatre de 4 sous-unités membranaires : ribophorines I et II, OST48 (oligosaccharyl-transférase de 48 kDa), et DAD-l (Defender against Apoptotic cell Death 1). Les quatre sous-unités seraient impliquées dans le transfert, et le segment transmembranaire de la ribophorine I, dans la reconnaissance du dolichol.L’oligosaccharyl-transférase est localisée sur la face luminale de la membrane. Elle intervient immédiatement après l’excision du peptide amino-terminal par la peptidase du signal, en transférant d’une chaîne glycanique sur un résidu asparagine du polypeptide en cours de synthèse. Comme l’enlèvement du peptide signal, la N-glycosylation est co-traductionnelle. Dans les cellules eucaryotes, l’oligosaccharyl-transférase catalyse le transfert du glycan :
du dolichol-pyrophosphate sur un résidu asparagine, au sein du triplet Asn-X-Ser/Thr des chaînes polypeptidiques naissantes. En étudiant le transfert de l’oligosaccharide sur des protéines sécrétoires dénaturées – ovalbumine, α-lactalbumine, ribonucléase A – William J. Lennarz et coll. (Department of Biochemistry and Cell Biology, Stony Brook University, New York) avaient montré, en 1977, que la présence de la séquence consensus Asn-X-(Ser/Thr) est nécessaire mais pas suffisante ; pour qu’un polypeptide soit accepteur d’un oligosaccharide, il doit être en conformation dépliée, sans structures secondaires, comme cela a été montré montré en mettant en contact une préparation membranaire d’oviducte de poulet avec les protéines dénaturées. C’est précisément dans cette conformation que se trouve le polypeptide en cours d’élongation ; il traverse la membrane par un canal hydrophile, émerge dans le lumen où a lieu le transfert de l’oligosaccharide.
Références : Pless DD, Lennarz WJ Enzymatic conversion of proteins to glycoproteins (1977)
Kronquist KE, Lennarz WJ Enzymatic conversion of proteins to glycoproteins by lipid-linked saccharides: a study of potential exogenous acceptor proteins (1978)
Pirozzi G Rat ribophorin II: molecular cloning and chromosomal localization of a highly conserved transmembrane glycoprotein of the rough endoplasmic reticulum (1991)
Kelleher J, Kreibich G, Gilmore R Oligosaccharyltransferase activity is associated with a protein complex composed of ribophorins I and II and a 48 kd protein (1992)
Fu J, Pirozzi G, Sanjay A, Levy R, Chen Y, De Lemos-Chiarandini C, Sabatini C, Kreibich G Localization of ribophorin II to the endoplasmic reticulum involves both its transmembrane and cytoplasmic domains (2000)
La décharge vectorielle des polypeptides en cours de synthèse se fait par un canal traversant la membrane du reticulum endoplasmique rugueux. Ce canal pourrait être en continuité avec celui qui traverse la grosse sous-unité ribosomiale, observé au microscope électronique par David Sabatini, Yutaka Tashiro et George Palade, après coloration négative. La nécessité d’un canal transmembranaire fut l’objet de débats. Certains polypeptides ont la capacité de traverser la bicouche phospholipidique en l’absence de liaison du ribosome à la membrane et sans passer par un canal. Mike Mueckler et Harvey F. Lodish ont synthétisé dans un extrait de germe de blé, et en présence de microsomes de pancréas, le transporteur du glucose (Human Glucose Transporter) et les fragments correspondant aux extrémités amino-terminale (340 résidus d’acides aminés) et carboxy-terminale (148 acides aminés). Ils ont observé l’insertion post-traductionnelle et l’intériorisation dans les microsomes du transporteur du glucose et du fragment amino-terminal, comme en témoigne la résistance à l’endoglycosidase H ou la trypsine.
Référence : Mueckler M, Lodish HF The human glucose transporter can insert posttranslationally into microsomes (1986)
Le canal, s’il existe, doit avoir un certain nombre de caractéristiques et de propriétés : il doit être constitué de protéines transmembranaires ; il doit permettre le passage des portions hydrophiles des polypeptides et les protéines luminales ou sécrétoires solubles, ainsi que le passage des portions hydrophobes des protéines intégrales mono- ou poly-topiques ; en l’absence de synthèse protéique, le canal doit être fermé pour empêcher le passage dans le lumen de micro molécules et d’ions. Il doit s’ouvrir lors de l’accostage du ribosome sur la membrane pour permettre la décharge co-traductionnelle vectorielle des peptides. En 1985, Gilmore et Blobel ont montré qu’un canal hydrophile formé de protéines membranaires intégrales est impliqué dans la translocation d’un polypeptide à travers la membrane microsomiale. Dans un système acellulaire de synthèse protéique et en présence de vésicules microsomiales, ils ont arrêté la décharge vectorielle d’un polypeptide à deux étapes de l’élongation : lorsqu’il avait une taille de ∼70 résidus (blocage par la particule de reconnaissance du signal) ou de ∼158 résidus (blocage par un oligonucléotide). Dans les deux cas, les polypeptides restaient liés à la membrane après détachement du ribosome ; ils étaient extrait par traitement avec un agent dénaturant soluble en milieu aqueux (urée 4M). Le transfert de la chaîne peptidique à travers la membrane se fait donc dans un microenvironnement hydrophile.
Référence : Gilmore R, Blobel G Translocation of secretory proteins across the microsomal membrane occurs through an environment accessible to aqueous perturbants (1985)
En 1989, l’existence d’un canal traversant la membrane du reticulum endoplasmique fut mise en évidence à la suite d’élégantes expériences d’électrophysiologie de Sanford Simon, Günter Blobel et Joshua Zimmerberg. Les mesures de conductance électrique de la membrane de microsomes rugueux de pancréas de chien, soumise à des différences de potentiel, révèlent l’existence de canaux ouverts lorsque le potentiel est négatif sur la face cytoplasmique de la membrane ; leur nombre augmente significativement après addition de GTP. Par contre les canaux sont fermés en présence d’ATP ou de guanosine 5′-[γ-thio] triphosphate, un analogue du GTP. Ces canaux pourraient permettre le transfert co-traductionnel des polypeptides néo-synthétisés.
Référence : Simon SM, Blobel G, Zimmerberg J Large aqueous channels in membrane vesicles derived from the rough endoplasmic reticulum of canine pancreas or the plasma membrane of Escherichia coli (1989)
Les résultats des expériences rapportées ci-dessus suggèrent l’existence de canaux transmembranaires (Protein-Conducting Channel) fonctionnels (ouverts) ou non-fonctionnels (fermés). Pour élucider le mécanisme du cycle d’ouverture et de fermeture, Sanford Simon et Günter Blobel ont utilisés les techniques d’électrophysiologie sur des microsomes rugueux de pancréas. Deux compartiments aqueux contenant une solution saline étaient séparés par une membrane constituée d’une bicouche phospholipidique. La face cytoplasmique des vésicules microsomiales était fusionnée à la face cis de la bicouche. L’addition de puromycine à forte concentration (100 μM) du côté cis provoque une nette augmentation de la conductance ; l’antibiotique détache les polypeptides traversant le canal ; l’addition de puromycine à faible concentration (0,33 μM) ouvre des canaux individuels. L’augmentation de la concentration saline (de 150 à 400 mM) du côté cis provoque la libération des ribosomes lié à la membrane et la fermeture des canaux. L’ouverture des canaux est déclenchée par l’accostage du ribosome sur la membrane du reticulum endoplasmique. Kathleen S. Crowley et coll. (Department of Chemistry and Biochemistry University of Oklahoma Norman) ont incorporé des sondes fluorescentes dans le peptique signal d’une protéine sécrétoire. L’extrémité amino-terminale de la protéine naissante se trouve dans un environnement aqueux dans le tunnel traversant la ribosome, et durant les premières étapes de la translocation à travers la membrane du reticulum endoplasmique. Günter Blobel a reçu le prix Nobel de médecine ou physiologie 1999.
Références : Simon SM, Blobel G A protein-conducting channel in the endoplasmic reticulum (1991)
Crowley KS, Reinhart GD, Johnson AE The signal sequence moves through a ribosomal tunnel into a noncytoplasmic aqueous environment at the ER membrane early in translocation (1993)
On a établi la structure cristallographique du translocon Sec de plusieurs espèces, en particulier celle du translocon simplifié des Archées (Methanococcus jannaschii). Chez les eucaryotes pluricellulaires, c’est un hétérotrimère Sec61α, Sec61β et Sec61γ ; les sous-unités α, β et γ sont très conservées, y compris chez la levure, les bactéries et les Archées ; la contribution des trois sous-unités est nécessaire au fonctionnement du pore. Après l’accostage du ribosome sur le récepteur de la SRP, l’interaction de ce récepteur avec Sec61 déclenche le transfert du complexe ribonucléoprotéique sur le translocon. La reprise de l’élongation du peptide force le clapet fermant le pore. Le transfert est vectoriel (l’extrémité N-terminale en premier) et unidirectionnel, du cytosol vers la lumière du reticulum. Le peptide signal à l’extrémité amino-terminale émerge le premier dans le lumen où il est excisé par la peptidase du signal. Lorsque la translocation du polypeptide, totale (protéines solubles) ou partielle (protéines membranaires), est achevée, le ribosome se détache du translocon et se dissocie en sous-unités.
Le translocon Sec de la membrane cytoplasmique des bactéries est responsable de la sécrétion des protéines et de l’insertion des protéines membranaires (insertase) ; il est constitué du complexe SecYEG et de deux protéines associées, dont l’insertase YidC. Son fonctionnement a été étudié par des méthodes physiques (diffusion de neutrons aux petits angles et microscopie électronique) par un groupe de chercheurs autour de Christiane Schaffitzel (European Molecular Biology Laboratory, Grenoble). Ils ont pu déterminer la disposition respective des composants du super-complexe avec une résolution de quelques dizaines de nanomètres. Ils ont proposé un modèle de translocon fonctionnel et un mécanisme d’insertion des protéines membranaires au sein d’une chambre centrale de nature lipidique. L’ouverture et la fermeture du translocon sont régulées par des séquences « topogéniques » : peptide signal séquence hydrophobe stop transfert. Après complétion de la décharge vectorielle du polypeptide, le canal se referme. Pour les protéines membranaires, après fermeture du pore, le ribosome se détache de la membrane et poursuit la synthèse de la portion cytosolique du polypeptide.
Références : Van den Berg B, Clemons Jr WM, Collinson I, Modis Y, Hartmann E, Harrison SC, Rapoport TA X-ray structure of a protein-conducting channel (2004)
Gulbart J, Schulten K Molecular Dynamics Studies of the Archaeal Translocon (2006)
Kumazaki K, Kishimoto T, Furukawa A, Mori H, Tanaka Y, Dohmae N, Ishitani R, Tsukazaki A, Nureki O Crystal structure of Escherichia coli YidC, a membrane protein chaperone and insertase (2014)
Botte M, Zaccai NR, Nijeholt JLA, Martin R, Knoops K, Papai G, Zou J, Deniau A, Karuppasamy M, Jiang Q, Roy AS, Schulten K, Schultze P, Rappsilbert J, Zaccai G, Berger I, Collinson I, Schaffitzel C A central cavity within the holo-translocon suggests a mechanism for membrane protein insertion (2016)
Martin R, Larsen AH, Corey RA, Midtgaard S R, Frielinghaus H, Schaffitzel C, Arleth L, Collinson I Structure and Dynamics of the Central Lipid Pool and Proteins of the Bacterial Holo-Translocon (2019)
Microsomes
Le terme « microsomes » a une connotation opérationnelle ; il désigne la fraction particulaire obtenue par centrifugation d’un surnageant post-mitochondrial à vitesse élevée (40.000 rpm pendant 30 à 60 minutes ou plus, selon les auteurs) dans un rotor angulaire (rotor Spinco 40). En 1955, George Palade et Philip Siekevitz identifièrent trois composants des microsomes : les vésicules lisses ou rugueuses dérivant de la fragmentation du réticulum endoplasmique et les ribosomes. Dans un article publié en 1962, Palade et Lars Ernster écrivaient : « It is well established that the microsomal fraction isolated from rat liver by usual differential centrifugation from rat liver homogenates consists of vesicular and tubular fragments of the endoplasmic reticulum. » Cette affirmation était tempérée dans la discussion : les auteurs évoquaient la présence possible d’éléments de la membrane péricellulaire. Dans un article antérieur (1956), ces mêmes auteurs avaient évoqué la présence d’éléments du complexe de Golgi dans la fraction microsomiale. Il faut voir dans ces affirmations de scientifiques reconnus l’origine de la confusion qui a perduré jusqu’au milieu des années 1970 entre microsomes (la fraction subcellulaire) et reticulum endoplasmique (l’organite).
La composition membranaire de la fraction microsomes dépend de façon critique de la façon dont elle a été préparée. Si l’objectif est d’obtenir des microsomes représentatifs du reticulum endoplasmique, il est impératif de respecter toutes les étapes du fractionnement en préparant d’abord une fraction nucléaire, puis une fraction mitochondriale et enfin des microsomes par centrifugation du surnageant post-mitochondrial. Il est impératif de procéder à un « lavage » de chaque culot : remise en suspension et centrifugation. Cette étape doit être effectuée deux fois pour chaque culot. Elle diminue la contamination du culot nucléaire par les organites de la fraction mitochondriale (mitochondries, lysosomes, peroxysomes). La vitesse de rotation du rotor, et par conséquent la force centrifuge, est calculée pour qu’une particule de la taille d’un noyau (5-7 micromètres de diamètre) parcourt la distance séparant le ménisque du liquide et le fond du tube du rotor. Dans ces conditions, une particule de la taille d’une mitochondrie (3 micromètres) se trouvant au milieu du tube au début de la centrifugation atteindrait le culot. La remise en suspension suivie de centrifugation, diminue donc la contamination inhérente au modus operandi, bien qu’un certain nombre d’expérimentateurs ont choisi de prépare le surnageant post-mitochondrial par sédimentation « en bloc » des fractions nucléaire et mitochondriale. La recommandation de préparer séparément ces deux fractions peut paraître triviale, mais elle est essentielle. En 1974, avec Henri Beaufay et un certain nombre de collègues, nous avons publié une série d’articles décrivant nos résultats obtenus entre 1965 et 1969 (la liste de ces articles est donnée dans le paragraphe « Bibliographie », à la fin du chapitre) : sur la base de la proportion des enzymes marqueurs des différents types de membrane, nous avions calculé que dans les microsomes tels que nous les préparions 77% des protéines provenaient du reticulum endoplasmique. La fraction contenait 75% de la glucose 6-phosphatase de l’homogénat, un enzyme marqueur du reticulum. Les 23% de protéines microsomiales restant venaient de la membrane péricellulaire (8%), des mitochondries (4,9%), du complexe de Golgi (4,3%), des peroxysomes (0,8%) et des lysosomes (0,5%). Loin de l’affirmation de Lars Ernster et Gustav Dallner (Karolinska Institutet, Stockholm) dans un article de 1968 : « The pellet constituents vary according to the tissue of origin : thus rough and smooth ER membranes are practically the only pellet constituent from liver tissue… », les microsomes de foie de rat contenaient, en plus des vésicules dérivant du reticulum endoplasmique, les membranes de deux autres compartiments (complexe de Golgi et membrane plasmique), ainsi qu’une proportion non négligeable de gros granules (mitochondries lysosomes, peroxysomes). La teneur en ARN (0,10 milligramme par milligramme de protéine) traduisait l’absence à peu près complète de polysomes libres dans nos microsomes. Le critère ARN/protéine fut utilisé pour la première fois par Abert Claude, le découvreur des microsomes, et repris en 1960 par Yvonne Moulé, Charles Rouiller et Jean Chauveau (Centre de Recherches sur la Cellule Normale et Cancéreuse, à Villejuif). Il faut se souvenir que pendant longtemps la seule fonction attribuée aux microsomes était la synthèse protéique. Dans la littérature, figurent des valeurs comprises entre 0,07 et 0,27 milligramme d’ARN par milligramme de protéine. Ces différences de 1 à 4, reflètent la variabilité des conditions d’obtention des microsomes obtenus par différents auteurs. Un rapport de 0,27 milligramme d’ARN par milligramme de protéine caractérise des microsomes fortement contaminés par des polysomes libres.
Microsomes lisses, microsomes rugueux
Les idées simplistes ont la vie dure
L’examen au microscope électronique de coupes de tissus hépatique ou pancréatique a révélé que le reticulum endoplasmique est formée de portions lisses, dépourvues de ribosomes, et de portions rugueuses, portant des ribosomes attachés à la face cytoplasmique de la membrane. La fragmentation en vésicules du reticulum endoplasmique lors de l’homogénéisation du tissus fut le point de départ de nombreuses tentatives de séparation des vésicules lisses ou rugueuses. L’on attribuait aux deux populations des fonctions spécifiques : la synthèse protéique pour les vésicules rugueuses et le métabolisme des xénobiotiques (voir plus loin) pour les vésicules lisses. La méthode la plus rapide et la plus directe pour effectuer cette séparation faisait appel à la centrifugation sur des couches de saccharose de densité décroissante, superposées dans le tube d’un rotor. La densité d’équilbre dans le saccharose des vésicules lisses est comprise entre 1,05 et 1,18, et celle des vésicules rugueuses, entre 1,18 et 1,25 g.cm-3. Il suffisait donc de choisir en fonction de ces données la densité des deux (ou plus) couches de saccharose. Dans le cas le plus simple (deux couches de saccharose), après centrifugation pendant une durée déterminée, généralement assez longue, on voyait se former à l’interface des deux couches une bande de microsomes lisses, et au fond du tube, un culot de microsomes rugueux. Le problème avec cette méthode de séparation sur « gradient discontinu », c’est que les prémisses étaient fausses.
A l’issue d’un méticuleux travail de morphologie quantitative, Maurice Wibo démontra, en 1971, que la charge en ribosomes des vésicules couvre tout le spectre allant de la vésicule lisse à celle ayant la charge maximale en ribosomes. Il n’y a donc pas deux populations distinctes sur la base de la charge en ribosomes des vésicules. Après centrifugation en gradient linéaire de saccharose, les enzymes marqueurs du reticulum endoplasmique (glucose 6-phosphatase et NADPH-cytochrome c réductase) sont distribués dans la totalité du gradient, de la densité 1,10 à la densité 1,27g.cm3. Ces distributions étalées reflétent le caractère « polydisperse » des vésicules : elles s’équilibrent dans le gradient en fonction de leur charge en ribosomes, les vésicules lisses dans la portion légère du gradient et les vésicules à forte charge en ribosomes dans la partie du gradient où la densité est la plus élevée ; entre les deux, s’étale un spectre continu de vésicules dont la densité d’équilibre croît proportionnellement à la charge en ribosomes. Ce résultat invalide la signification des résultats expérimentaux établissant un lien entre les propriétés biochimiques et enzymatiques des microsomes et leur caractère lisse ou rugueux. La centrifugation sur couches de saccharose de densités différentes pour séparer deux populations de vésicules, pratiquée dans de nombreux laboratoires, introduit une coupure arbitraire au sein d’une population continue de vésicules dont les propriétés biochimiques varient en proportion mais pas en nature ; il y a moins d’oxygénases à fonction mixte dans les vésicules très rugueuses que dans les vésicules lisses, mais il y en a.
Référence : Wibo M, Amar-Costesec A, Berthet J, Beaufay H Electron Microscope Examination of Subcellular Fractions. III. Quantitative Analysis of the Microsomal Fraction Isolated from Rat Liver (1971)
« Membrane flow » versus
Homogénéité biochimique des membranes
Au cours de la décennie 1960-1970, plusieurs groupes de chercheurs purifièrent des membranes cellulaires et établirent leur composition biochimique. La membrane péricellulaire, isolée en 1960 par David M. Neville (Department of Pathology, University of Rochester School of Medicine and Dentistry), renferme des enzymes hydrolysant les liaisons ester- ou diester-phosphate (phosphatase alcaline, phosphodiestérase alcaline I, 5’-nucléotidase) ; cette dernière hydrolyse les nucléotides puriques, adénine et guanine ; le complexe de Golgi, isolé en 1969 par Rebecca Fleischer, Sidney Fleisher et Hidehiro Ozawa (Department of Molecular Biology, Vanderbilt University, Nashville) contient les galactosyl- et sialyltransférases ; la membrane externe des mitochondries, isolée par D.F. Parsons, G.R. Williams et Britton Chance (Department of Biophysics and Physical Biochemistry, Johnson Foundation, University of Pennsylvania, Philadelphia), renferme la monoamine oxydase, une oxydase à fonction mixte catalysant l’oxydation des monoamines biologiques comme la sérotonine. La glucose 6-phosphatase (une phosphatase participant à la régulation du taux sanguin de glucose) et la NADPH cytochrome c réductase (une oxydoréductase de la chaîne respiratoire du reticulum endoplasmique) ont leur pic d’activité spécifique le plus élevé dans les microsomes, dont le composant principal dérive de la fragmentation en vésicules du reticulum endoplasmique. Chaque préparation membranaire prise individuellement renferme des enzymes qui lui sont spécifiques mais aussi une certaine proportion d’enzymes caractéristiques des autres types membranaires. Il y a deux interprétations possibles à cet état de fait : (i) soit on suppose que ces enzymes caractéristiques des autres types membranaires contaminent les préparations les plus « pures » que l’on puisse obtenir ; (ii) soit un enzyme donné n’est pas exclusivement associé à un seul type de membrane. En d’autres termes, les différents compartiments membranaires différent-ils entre eux qualitativement ou quantitativement ? La réponse à cette question est cruciale pour concevoir un mécanisme de la biogenèse des membranes et, d’une manière plus générale, des différents compartiments de la cellule. La première hypothèse était celle qui avait la faveur des membres du Groupe de Louvain, conformément au postulat d’homogénéité sur lequel Jacques Berthet et Christian de Duve avaient fondé l’approche quantitative du fractionnement subcellulaire. L’analyse de la fraction des gros granules, qui avait conduit à la découverte des lysosomes et des peroxysomes, avait été conduite en appliquant ce postulat. La seconde hypothèse semblait être en faveur parmi les microscopistes du groupe de George Palade. En 1974, Marylin Farquhar avait détecté la présence de phosphatase acide, un enzyme des lysosomes, et d’adénylate cyclase et de 5’-nucléotidase, deux enzymes de la membrane plasmique, dans le complexe de Golgi. Des localisations multiples furent rapportées par d’autres membres du groupe (cités dans Références II). De ces résultats, on pouvait conclure que les membranes des différents types présentaient entre elles des différences quantitatives et non qualitatives. Le « model of flow-differentiation » (ou « membrane flow »), formulé par D. James Morré (Department of Chemistry and Pharmacology, Purdue University, West Lafayette) était l’interprétation poussée à l’extrême de cette option : il existerait un gradient de concentration en enzymes le long de la voie sécrétoire, du réticulum vers la membrane plasmique ; la teneur en glucose 6-phosphatase élevée dans le réticulum, irait en diminuant du reticulum au complexe de Golgi et du complexe de Golgi à la membrane péricellulaire ; à l’inverse la concentration en 5’-nucléotidase irait en décroissant de la membrane plasmique au complexe de Golgi et au reticulum endoplasmique. Au cours de ce processus, les compartiments de la chaîne d’assemblage et de transport des protéines (reticulum endoplasmique, complexe de Golgi, membrane péricellulaire) établissent entre eux des continuités anatomiques, au moins transitoires. Si l’on prend en compte la fluidité de la bicouche lipidique, on se demande à juste titre comment ces compartiments acquièrent et maintiennent une stricte individualité biochimique.
Références : Neville DM The Isolation of a Cell Membrane Fraction from Rat Liver (1960)
Fleischer R, Fleisher S, Ozawa H Isolation and characterization of Golgi membranes from bovine liver (1969)
Parsons DF, Williams GR, Chance B Characteristics of isolated and purified preparations of the outer and inner membranes of mitochondria (1966)
Farquhar MG, Bergeron JJM, Palade GE Cytochemistry of Golgi fractions prepared from rat liver (1974)
Cheng H, Farquhar MG Presence of adenylate cyclase activity in Golgi and other fractions from rat liver. II. Cytochemical localization within Golgi and ER membranes (1976)
Borghese N, Meldolesi J Localization and biosynthesis of NADH cytochrome b5 reductase, an integral membrane protein, in rat liver cells. I. Distribution of the enzyme activity in microsomes, mitochondria, and Golgi complex (1980)
Howell KE, Ito A, Palade GE Endoplasmic marker enzymes in Golgi fractions. What does this mean? (1978)
Ito A, Palade GE Presence of NADPH-cytochrome P450 réductase in rat liver Golgi membranes. Evidence obtained by immunoadsorption method (1978)
Widnell CC Cytochemical localization of 5’-nucleotidase in subcellular fractions isolated from rat liver. I. The origin of 5’-nucleotidase activity in microsomes (1972)
Jarash ED, Kartenbeck J, Bruder G, Fink A, Morré DJ, Franke WW B-type cytochromes in plasma membranes isolated from rat liver, in comparison with those of endomembranes (1979)
En mai 1979, Günter Blobel (Department of Cell Biology, The Rockefeller University) et David Sabatini (New York University Medical Center) organisèrent au Cold Spring Harbor Laboratory (New York), un colloque sur le thème “Membrane Biogenesis”. A cette réunion, je présentais notre travail avec Maurice Wibo, Danièle Godelaine et Denise Thines-Sempoux – qui sera publié deux ans plus tard. L’homogénéisation du tissu hépatique provoque la fragmentation de la membrane plasmique : la moitié des fragments – les plus grands – sédimentent avec les noyaux ; l’autre moitié, ceux dérivant de la membrane en contact avec l’espace de Disse et le plasma sanguin, sédimentent dans les microsomes. Après équilibration des microsomes en gradient de saccharose, les enzymes marqueurs de la membrane plasmique (5’-nucléotidase, phosphatase alcaline, phosphodiestérase alcaline I) s’équilibrent à la densité 1,14, ou 1,17 s’il s’agit d’une préparation purifiée de membrane plasmique (qui contient davantage de jonctions serrées, plus riches en protéines et donc plus denses que la zone des villosités en contact avec le plasma). Nous avons montré que les fragments de membrane plasmique présentent deux propriétés singulières : en présence de digitonine, leur densité d’équilibre augmente (« digitonin shift») ; l’addition de cette saponine aux microsomes (une mole de saponine par mole de cholestérol) provoque une augmentation de la densité d’équilibre des marqueurs de ce groupe de 0,03 à 0,04 g.cm3. Les fragments de membrane plasmique traités à la digitonine présentent un aspect caractéristique. L’examen au microscope électronique permet de les distinguer des autres membranes par leur aspect « fenestré », probablement dû à des dépôts de complexe digitonine-cholestérol. Ces deux propriétés s’observent aussi bien avec les microsomes qu’avec des préparations purifiées de membrane plasmique. Si la 5’-nucléotidase et les autres enzymes de la membrane plasmique que l’on trouve dans des préparations purifiées de complexe de Golgi ou de membrane externe de mitochondries appartiennent vraiment à ces entités subcellulaires, ils ne devraient pas présenter de digitonin shift et l’on ne devrait pas trouver de fragments membranaires à l’aspect fenestré. Le fait que ces deux particularités se retrouvent dans ces préparations purifiées plaide en faveur d’une contamination par des fragments de membrane plasmique. Si cela n’avait pas été le cas et si le même enzyme (la 5’-nucléotidase, par exemple) avait appartenu à plus d’un type membranaire, il se comporterait de façon variable en fonction de la préparation membranaire analysée. Avec le même type d’approche utilisant un « perturbateur de densité », il fut possible de montrer que le reticulum endoplasmique ne renferme pas de 5’-nucléotidase. Dans ce cas, le perturbateur de densité n’était pas la digitonine mais le pyrophosphate (ou un chélateur de cations comme l’EDTA) qui détache les ribosomes liés aux vésicules microsomiales rugueuses dérivant du reticulum endoplasmique. Ce traitement provoquait un allègement significatif de ces vésicules, se traduisant par une densité d’équilibre moins élevée pour les marqueurs enzymatiques du reticulum (glucose 6-phosphatase, estérase, UDP glucuronosyltranférase), mais pas pour la 5’-nucléotidase. Le traitement des microsomes successivement par la digitonine et le pyrophosphate, provoquait une augmentation de la densité d’équilibre de la 5’nucléotodase et une diminution de celle de la glucose 6-phosphatase, excluant toute association de la 5’-nucléotidase au reticulum endoplasmique.
C’est peu de dire qu’à la fin de ma présentation la discussion fut animée. A titre d’illustration des divergences de point de vue, je cite dans Références le titre de l’exposé de Nica Borghese (C.N.R. Center of Cytopharmacology, University of Milan), dans lequel elle concluait à la présence de NADH cytochrome b5 reductase dans le reticulum endoplasmique, la membrane mitochondriale externe et le complexe de Golgi. Par contre, David Sabatini et Günter Blobel saisirent la signification de nos résultats dans l’optique de leur « hypothèse du signal » (Signal Hypothesis) proposée en 1971 : la liaison du ribosome à la membrane du reticulum endopasmique dépend de la présence d’un « signal » porté par le peptide en cours de synthèse. En d’autres termes, les polypeptides sont dotés d’une « adresse », d’un « code postal » stipulant leur destination finale dans ou hors de la cellule. Cela implique que la membrane de destination du polypeptide synthétisé – et elle seule – possède le récepteur ad hoc reconnaissant le signal. La notion de différence qualitative entre membranes de différents types était compatible avec cette hypothèse.
Références : Amar-Costesec A, Beaufay H, de Duve C The distribution of enzymes in subcellular membranes from rat liver (1979) Abstracts of papers presented at the meeting on Membrane biogenesis
Wibo M, Thinès-Sempoux D, Amar-Costesec A, Beaufay H, Godelaine D Analytical Study of Microsomes ans Isolated Subcellular Membranes from Rat Liver. VIII. Subfractionation of preparations enriched with plasma membranes outer mitochondrial membranes, or Golgi complex membranes (1981)
Borghese N, Meldolesi J Biogenesis and turnover of NADH cytochrome b5 reductase, a membrane protein with multiple localization in rat hepatocytes (1979) Abstracts of papers presented at the meeting on Membrane biogenesis
Thinès-Sempoux D, Amar-Costesec A, Beaufay H, Berthet J The Association of Cholesterol, 5’-Nucleotidase and Alkaline Phosphodiesterase I with a Distinct Group of Microsomal Particles (1969)
Amar-Costesec A, Wibo M, Thinès-Sempoux D, Beaufay H, Berthet J Analytical Study of Microsomes ans Isolated Subcellular Membranes from Rat Liver. IV. Biochemical, Physical and Morphological Modifications of Microsomal Components Induced by Digitonin, EDTA and Pyrophosphate (1974)
Hétérogénéité biochimique du reticulum endoplasmique
Le reticulum endoplasmique des hépatocytes est un vaste réseau membranaire (plusieurs m2 par g de foie) renfermant des centaines de protéines différentes (voir le tableau, en fin de chapitre, adapté de la revue publiée en 1989). Lorsque l’on centrifuge, des mitochondries, des lysosomes, ou des peroxysomes dans un gradient de saccharose, jusqu’à l’équilibre isopycnique, tous les constituants de ces organites présentent des profils de distribution de densité semblables. On aurait pu s’attendre à ce qu’il en soit de même pour le réticulum : ce n’est pas le cas. Avec Henri Beaufay, nous avons montré que ces enzymes se distribuent selon trois modes : (i) le profil de distribution des flavoprotéines – NADH cytochrome b5 et NADPH cytochrome P-450 réductases – et des cytochromes présente un pic à la densité 1,14, correspondant à la densité modale des vésicules lisses issues de la fragmentation du reticulum pendant le broyage des tissus ; (ii) celui de l’ARN ribosomial présente un pic à la densité 1,23 ; John A. Todd et Eugene Marcantonio (Department of Cell Biology, New York University School of Medicine) ont montré que ce mode de distribution était aussi celui des ribophorines (oligosaccharyl-transférase), et Bernard Dublet (International Institute of Cellular and Molecular Pathology, Bruxelles), celui du récepteur de la particule de reconnaissance du signal et de la peptidase du signal ; (iii) la glucose 6-phosphatase, l’UDP glucuronosyl transférase et les estérases se répartissent de manière assez uniforme le long du gradient, des densités 1,10 à 1,25. En 1971, Le fait que les vésicules dérivant du reticulum se distribuent selon un large éventail de densités traduit leur « caractère polydisperse » ; Maurice Wibo (International Institute of Cellular and Molecular Pathology, Bruxelles) a établi que cette caractéristique s’explique par leur charge en ribosomes : les fractions de faible densité renferment les vésicules lisses ; les fractions de densité élevée contiennent des vésicules à forte charge en ribosomes ; entre les deux, existe un spectre continu de vésicules dont la densité d’équilibre croît proportionnellement à la charge en ribosomes. Glucose 6-phosphatase et NADPH-cytochrome c réductase sont présentes dans les vésicules lisses et dans les vésicules rugueuses.
Références : Amar-Costesec A Reticulum endoplasmique: anatomie d’une membrane biologique (1989)
Beaufay H, Amar-Costesec A, Thinès-Sempoux D, Wibo M, Robbi M, Berthet J Analytical Study of Microsomes and Isolated Subcellular Membranes from Rat Liver. III. Subfractionation of the Microsomal Fraction by Isopycnic and Differential Centrifugation in Density Gradients (1974)
Amar-Costesec A, Todd JA, Kreibich G Segregation of the Polypeptide Translocation Apparatus to Regions of the Endoplasmic Reticulum Containing Ribophorins and Ribosomes. I. Functional Tests on Rat Liver Microsomal Subfractions (1984)
Marcantonio EE, Amar-Costesec A, Kreibich G Segregation of the Polypeptide Translocation Apparatus to Regions of the Endoplasmic Reticulum Containing Ribophorins and Ribosomes. II. Rat Liver Microsomal Subfractions Contain Equimolar Amounts of Ribophorins and Ribosomes (1984)
Amar-Costesec A, Dublet B, Beaufay H Translocation and proteolytic processing of nascent secretory polypeptide chains: two functions associated with the ribosomal domain of the endoplasmic reticulum (1989)
Wibo M, Amar-Costesec A, Berthet J, Beaufay H Electron Microscope Examination of Subcellular Fractions. III. Quantitative Analysis of the Microsomal Fraction Isolated from Rat Liver (1971)
Il y a deux interprétations possibles au fait que les constituants du reticulum présentent des profils de distribution différents : (i) il existe deux réseaux membranaires, l’un portant les chaînes de transport d’électrons et l’autre, la glucose 6-phosphatase. Cette hypothèse de la multiplicité fut écartée à la lumière d’observations au microscope électronique : (i) Stanley Fowler et José Remacle montrèrent que des anticorps hybrides anti-cytochrome b5– anti-ferritine marqués à la ferritine décorent toutes les vésicules microsomiales ; (ii) A. Leskes (The Rockefeller University), a montré que le dépôt de phosphate de plomb produit par la réaction cytochimique de la glucose 6-phosphatase sur le glucose 6-phosphate est réparti sur tout le reticulum ; (iii) Shiro Matsuura (Department of Physiology, Kansaï Medical University, Osaka) a montré que des anticorps anti-cytochrome P-450 conjugués à la ferritine décorent toutes les vésicules microsomiales ; (iv) Tsuneo Morimoto a montré que des anticorps anti-NADPH cytochrome c réductase conjugués à la ferritine marquent la surface externe de tout le réticulum endoplasmique. L’hypothèse de l’unicité du reticulum était validée ; la composition biochimique et enzymatique des vésicules lisses et rugueuses issues de la fragmentation du reticulum est qualitativement mais pas quantitativement la même.
Références : Remacle J, Fowler S, Beaufay H, Amar-Costesec A, Berthet J Analytical Study of Microsomes and Isolated Subcellular Membranes from Rat Liver. V. electron microscope examination of microsomes for cytochrome b5 by means of a ferritin-labeled antibody (1976)
Leskes A, Siekevitz P, Palade G Differentiation of endoplasmic reticulum in hepatocytes II. Glucose-6-phosphatase in Rough Microsomes (1971)
Matsuura S, Fujii-Kuriyama Y, Tashiro Y Immunoelectron microscope localization of cytochrome P-450 on microsomes and other membrane structure (1978)
Morimoto T, Matsuura S, Sazaki S, Tashiro Y, Omura T Immunochemical and immunoelectron microscope studies on the localization of NADPH-cytochrome c reductase (1976)
Étant établi que le reticulum endoplasmique des hépatocytes est unique, il fallait trouver une explication à son hétérogénéité biochimique établie par (i) nos expériences de centrifugation isopycnique ; (ii) des résultats de centrifugation différentielle en gradient de densité ; (iii) des expériences de solubilisation différentielle des constituants microsomiaux par la digitonine ; (iv) la mesure des taux de renouvellement (turn over) individuels des protéines du réticulum. En 1981, j’ai formulé une hypothèse sur la distribution latérale des enzymes du réticulum, c’est-à-dire sur leur répartition entre portions lisses et rugueuses. Le fait que les différences de distribution en gradient de densité soient quantitatives et non qualitatives révélait une hétérogénéité organisée de la face cytosolique de la membrane : elle serait un mélange de constituants du domaine ribosomial (complexes supramoléculaires de ribosomes et de la machinerie de translocation des protéines à travers la membrane) et de constituants du domaine lisse ; les deux chaînes de transport d’électrons de ce domaine formeraient des complexes protéiques oligomériques distincts, comme l’ont suggéré Lars Ernster et ses associés (Wenner-Gren Institute, Stockholm Universitet). Ils ont tenté d’en faire la démonstration en fragmentant les microsomes rugueux par traitement aux ultrasons, et en séparant des fragments de compositions biochimiques différentes. Les complexes de flavoprotéines et de cytochromes ont été observés au microscope électronique par Shiro Matsuura et par Tsuneo Morimoto, cités ci-dessus. Ces résultats nous ont conduit à proposer dans notre article de 1981 une représentation en “ peau de léopard” pour la face cytosolique de la membrane du reticulum, avec des taches noires (le domaine ribosomial) sur fond clair (le domaine lisse des oxydoréductases).
Références : Amar-Costesec A, Beaufay H A structural basis of enzymic heterogeneity within liver endoplasmic reticulum (1981)
Beaufay H, Amar-Costesec A, de Duve C The topology of enzymes in microsomes from liver (1981)
Eriksson LC, Bergstrand A, Dallner G Lateral enzyme topology in the rough endoplasmic reticulum of rat liver (1977)
Dallman PR, Dallner G, Bergstrand A, Ernster L Heterogeneous Distribution of Enzymes in Submicrosomal Membrane Fragments (1969)
Oxygénases microsomiales
Très tôt après leur découverte, les microsomes furent associés à la synthèse protéique. A la fin des années 1940, Christian de Duve (International Institute of Cellular and Molecular Pathology, Bruxelles) identifia, en 1949, le premier enzyme microsomial sans rapport avec ce processus, la glucose 6-phosphatase. Les propriétés cinétiques et la localisation de l’enzyme furent étudiées par Henri Géry Hers et Henri Beaufay. Depuis cette découverte, plusieurs centaines d’enzymes microsomiaux ont été répertoriés (voir le Tableau à la fin du chapitre). La synthèse des chaînes glycaniques des glycoprotéines et des glycolipides met en jeu la coopération du réticulum endoplasmique et du complexe de Golgi, deux composants qui sédimentent dans les microsomes. La métabolisation et l’élimination des « xénobiotiques » est présente sous une forme plus ou moins élaborée dans pratiquement toutes les cellules, des bactéries aux mammifères. On désigne sous le nom de xénobiotique toute substance étrangère à l’organisme, introduite volontairement ou accidentellement dans l’organisme, par voie orale, pulmonaire ou cutanée : polluants atmosphériques, colorants, additifs alimentaires, substances médicamenteuses, hydrocarbures polycycliques cancérigènes, pesticides… La plupart de ces molécules ont un caractère hydrophobe. En l’absence d’un mécanisme physiologique d’élimination efficace, ces substances s’accumulent dans les tissus adipeux de l’organisme, ce qui explique leur dangerosité potentielle pour la santé. Après la Seconde Guerre mondiale, des taux anormalement élevés d’un pesticide largement utilisé à l’époque, le dichlorodiphényltrichloroéthane (DDT) ont été retrouvés dans le système nerveux central de patients décédés. L’usage intensif du DDT fut dénoncé par la biologiste Rachel Carson dans son célèbre ouvrage « Silent Spring », publié en 1962. Elle y décrivait les effets nocifs des pesticides sur les populations d’oiseaux. Cette dénonciation, à l’origine du mouvement écologiste, amena des restrictions sévères à l’emploi du DDT, et jusqu’à son interdiction.
Gerald C. Mueller, dans le laboratoire de James A. Miller et d’Elizabeth C. Miller (McArdle Memorial Laboratory, The University of Wisconsin), découvrit que le foie joue un rôle dans le métabolisme du DAB (N,N-Diméthyl-4-AminoazoBenzène). On soupçonnait ce colorant aminoazoïque de se lier à des protéines cellulaire et d’être cancérigène, alors qu’à l’époque il était utilisé dans l’alimentation sous le nom de « jaune de beurre » ! Mueller et Miller montrèrent qu’une fraction particulaire, préparée à partir d’un homogénat de foie de rat, catalyse la N-déméthylation (l’enlèvement d’un groupe méthyle CH3- lié à un atome d’azote) du DAB en présence d’oxygène et d’un nucléotide pyridinique réduit, le NADPH. Dans les années 1950, Julius Axelrod, sous la supervision de Bernard B. Brodie (Laboratory of Chemical Pharmacology, National Institutes of Health), élucida le mécanisme physiologique de transformation de l’acétanilide en aniline. L’acétanilide, présent dans un médicament très populaire, le Bromo Seltzer, prescrit aux patients souffrant de brûlures gastriques, provoquait une méthémoglobinémie ; la méthémoglobine est un produit d’oxydation de l’hémoglobine dont l’atome de fer ferreux (Fe2+) a été transformé en fer ferrique (Fe3+). Axelrod est surtout connu pour ses travaux sur les neurotransmetteurs de la famille des catécholamines, comme l’adrénaline ou la noradrénaline, travaux pour lesquels il reçut le prix Nobel médecine ou physiologie en 1970. Il débuta sa carrière comme postier avant de devenir technicien de laboratoire à New York University. Il s’intéressa aussi au métabolisme d’agents psychotropes : amphétamines et éphédrine et caractérisa les trois ingrédients indispensables à leur transformation : microsomes, TPNH et oxygène.
Références : Mueller GC, Miller JA The reductive cleavage of 4-dimethylaminoazobenzene by rat liver: The intracellular distribution of the enzyme system and its requirement for triphosphopyridine nucleotide (1949)
Brodie BB, Axelrod J The estimation of acetanilide and its metabolic products, aniline, N-acetyl p-aminophenol and p-amino-phenol, free and total conjugated, in biological fluids and tissues (1948)
La présence de transporteurs d’électrons fut mise en évidence par Kenneh J. Ryan et Lewis Engel; ils montrèrent que les microsomes de la glande corticosurrénale de bœuf catalysent l’hydroxylation d’une hormone, la progestérone, en présence de TPNH (NADPH) et d’oxygène. La réaction était inhibée par le monoxyde de carbone. En 1962, Tsuneo Omura et Ryo Sato (Osaka University Institute for Protein Research) découvrirent un nouveau cytochrome (le futur cytochrome P450). Ronald W. Estabrook (University of Texas Southwestern Medical Center) montra son implication dans la réaction étudiée par Ryan et Engel et sa fonction de mono-oxygénase. Les « oxydases à fonction mixte » microsomiales catabolisent un cancérigène, le DAB, un médicament, l’acétanilide, ou les stéroïdes, en scindant une molécule d’O2 en deux atomes d’oxygène, dont l’un se fixe sur le substrat et l’autre se combine à l’eau pour former une molécule de peroxyde d’hydrogène, d’où le nom de « mono-oxygénases » par lequel on les désigne. Les substrats des mono-oxygénases présentent une grande diversité de structures moléculaires et d’hydrophobicité. A la fin des années 1950, des flavoprotéines et des cytochromes furent localisés dans les microsomes. En 1958, dans le laboratoire de Britton Chance (Johnson Foundation), le physicochimiste Martin Klingenberg et un étudiant postdoctoral, David Garfinkel (Harvard University), identifièrent dans les microsomes de foie de rat et de porc un pigment liant le monoxyde de carbone (CO). En 1964, Sato et Omura montrèrent qu’il s’agissait d’une hémoprotéine, avec un hème de type b. Ils proposèrent de l’appeler cytochrome P450, car le spectre différentiel du complexe entre le CO et le pigment réduit présente un pic d’absorption à 450 nm. Ce nom fut adopté malgré sa non-conformité avec la nomenclature des cytochromes et leur classement en quatre groupes : a, b, c et d, selon la nature de l’hème du groupement prosthétique.
Références : Ryan KJ, Engel LL Hydroxylation of steroids at carbon 21 (1957)
Omura T, Sato R A new cytochrome in liver microsomes (1962)
Estabrook RW, Cooper DY, Rosenthal O The light reversible carbon monoxide inhibition of the steroid C21-hydroxylase system of the adrenal cortex (1963)
Klingenberg M Pigments of rat liver microsomes (1958)
Garfinkel D Studies on pig liver microsomes. I. Enzymic and pigment composition of different microsomal fractions (1958)
Omura T, Sato R The carbon monoxide-binding pigment of liver microsomes. I. Evidence for its hemoprotein nature (1964)
Les flavoprotéines sont des transporteurs d’électrons contenant un ou deux coenzymes dont la structure est apparentée à celle de la riboflavine (vitamine B2). Les flavoprotéines transfèrent généralement des électrons à des cytochromes. L’existence de flavoprotéines mitochondriales était connue : en 1949, George Hogeboom avait montré, en fractionnant par centrifugation différentielle des homogénats de foie de rat, de foie de souris ou d’hépatome murin, qu’une flavoprotéine, la DPNH cytochrome c réductase, est localisée dans les microsomes. La même année, Bernard L. Horecker (National Institute of Health), le découvreur de la voie des pentoses phosphate, caractérisa une TPNH cytochrome c réductase. George Hogeboom et Walter Schneider, anciens collaborateurs d’Albert Claude et pionniers de la localisation subcellulaire des enzymes par centrifugation différentielle, montrèrent que la proportion de TPNH cytochrome c réductase présente dans les microsomes est plus élevée que celle de DPNH cytochrome c réductase. Après les flavoprotéines, ce fut au tour des cytochromes : Charles F. Strittmatter et Eric Glendinning Ball (Department of Biological Chemistry, Harvard Medical School, Boston) rapportèrent la présence d’une hémoprotéine, le cytochrome m, dans les microsomes hépatiques. Ce cytochrome n’était pas inconnu ; il avait été identifié par David Keilin et E.F. Hartree (Molteno Institute for Research in Parasitology, University of Cambridge, UK)), en 1940, et appelé cytochrome b1. Alwyn M. Pappenheimer et Carroll M. Williams (Department of Bacteriology, New York University School of Medicine) le baptisèrent cytochrome b5. En 1956, Philipp Strittmatter et Sidney F. Velick (Department of Biological Chemistry, Washington University School of Medicine, St. Louis) isolèrent à partir de foie de lapin un enzyme catalysant le transfert d’électrons du diphosphopyridine nucléotide réduit (DPNH, NADH) à un cytochrome microsomial, puis au cytochrome c. Les pièces du puzzle s’assemblèrent : les deux chaînes microsomiales de transport d’électrons sont composées chacune d’une flavoprotéine réductase et de cytochromes : (i) NADH : cytochrome b5 oxydoréductase et (ferri)cytochrome b5 (ii) NADPH : cytochrome P450 oxydoréductase et cytochrome P450 (il en existe une variété ; voir ci-dessous) ; l’oxydoréductase renferme une molécule de flavine adénine dinucléotide (FAD) et une molécule de flavine adénine mononucléotide (FMN). Les électrons suivent le trajet :
La cytochrome P-450 réductase fournit des électrons à quatre voies métaboliques : (i) celle des cytochromes P450, une superfamille d’hémoprotéines comprenant plus de deux mille membres impliqués dans le métabolisme des xénobiotiques (contaminants et cancérigènes chimiques, pesticides) et des médicaments, et dans la synthèse d’endobiotiques (stérols, acides biliaires) ; (ii) celle du cytochrome b5 et des désaturases et élongases impliquées dans la transformation des acides gras ; (iii) aux enzymes de la biosynthèse des stérols (7 déhydrocholestérol réductase, squalène mono-oxygénase, cytochrome b5) ; (iv) celle de l’hème oxygénase, qui catalyse les étapes finale du catabolisme de l’hème chez les mammifères. Le catabolisme des xénobiotiques comporte deux phases : au cours de la phase I (phase d’oxydation), des substrats hydrophobes sont transformés en molécules polaires par les mono-oxygénases ; au cours de la phase II (phase de conjugaison) les produits d’oxydation sont conjugués par une liaison covalente à des molécules facilitant leur excrétion par le rein. On classe parmi les enzymes de la phase I l’époxyde hydrolase (les époxydes sont des molécules très réactives susceptibles d’endommager les constituants cellulaires comme les acides nucléiques). Parmi les enzymes de la phase II, on trouve l’UDP-glucuronosyl transférase qui conjugue la bilirubine à une molécule d’acide glucuronique. La bilirubine est un métabolite naturel, mais son accumulation dans l’organisme a des effets néfastes (jaunisse). La déficience en bilirubine glucuronosyltransférase est à l’origine de la maladie de Gilbert (déficit partiel) ou de la maladie de Crigler-Najjar (déficit total), une maladie très rare à transmission autosomique récessive. Un autre enzyme de la phase II, la sulfotransférase, catalyse le transfert d’un groupe sulfate sur un groupe alcool ou aminé d’un accepteur (un stéroïde, par exemple). Le donneur de sulfate est le 3’-phosphoadénosine 5’-phosphosulfate (PAPS).
La NADH cytochrome b5 réductase est une flavoprotéine à FAD, qui transmet les électrons du NADH à un transporteur ubiquitaire, le cytochrome b5. C’est un enzyme membranaire dont le site actif est orienté vers le cytosol. Il en existe une forme « soluble » dans les hématies : la NADH méthémoglobine réductase, qui catalyse la réduction de la méthémoglobine ; ce produit d’oxydation de l’hémoglobine est incapable de fixer l’oxygène et, donc, de le transporter vers les tissus. La méthémoglobinémie héréditaire est une pathologie provoquée par la déficience génétique (autosomique récessive) en NADH cytochrome b5 réductase. Cette maladie génétique rare affecte les globules rouges et se traduit, à la naissance, par une cyanose par déficit du transport de l’oxygène.
La stéaroyl CoA désaturase (Δ-9 désaturase) est une oxydoréductase microsomiale qui transforme l’acide stéarique – un acide gras saturé – en acide oléique. La stéaroyl CoA désaturase reçoit ses électrons du cytochrome b5 et introduit une double liaison dans la chaîne aliphatique de l’acide stéarique. Cette réaction de désaturation C9-C10 est une étape limitante de la biosynthèse des acides gras insaturés, une des fonctions importantes du reticulum endoplasmique. L’importance de la stéaroyl CoA désaturase comme régulateur du métabolisme et son rôle dans l’apparition du « syndrome métabolique », dont l’obésité est une manifestation préoccupante, a été longtemps méconnue.
Références : Hogeboom GH Cytochemical studies of mammalian tissues. II. The distribution of diphosphopyridine nucleotide-cytochrome c reductase in rat liver fractions (1949)
Horecker BL, Heppel LA The reduction of cytochrome c by xanthine oxidase (1949)
Hogeboom GH, Schneider WC Cytochemical studies of mammalian tissues. III. Isocitric dehydrogenase and triphosphopyridine nucleotide-cytochrome c reductase of mouse liver (1950)
Strittmatter CF, Ball EG A Hemochromogen Component of Liver Microsomes (1952)
Pappenheimer AM, Williams CM Cytochrome b5 and the dihydro-coenzyme I-oxidase system in the cecropia silkworm (1954)
Strittmatter P, Velick SF A Microsomal Cytochrome Reductase Specific for Diphosphopyridine Nucleotide (1955)
Fonctions du reticulum endoplasmique des hépatocytes
| Synthèse et maturation des protéines (du reticulum endoplasmique, des lysosomes, du complexe de Golgi, de la membrane plasmique, et des protéines sécrétoires); repliement et modifications post-traductionnelles |
|---|
| Récepteur de la particule de reconnaissance du signal; complexe de translocation (translocon, Sec61); peptidase du signal; chaperones Bip, GRP (Glucose-regulated protein); protéine disulfure isomérase; protéine de choc thermique 70 kDa 5; calnexine; calréticuline; ERp57 (Endoplasmic Reticulum protein 57kDa); peptidyl-prolyl cis/trans isomérase |
| Biosynthèse et modifications des chaînes oligosaccharidiques et glycosylation des protéines |
| N-acétylglucosamine-phosphotransférase ; N-acétylglucosamine-transférase ; mannosyl-transférase ; glucosyl-transférase ; Oligosaccharyl-tranférase (ribophorines I et II) |
| glucosidase II; mannosidases |
| Biosynthèse et métabolisme des lipides, des glycérophospholipides, et du plasmalogène |
| NADH cytochrome b5 réductase (désaturation et élongation des acides gras), glycérophosphate (dihydroxyacétone phosphate) acyltransférase ; acide lysophosphatidique acyltransférase |
| Biosynthèse des stéroïdes |
| stéroïde aromatase (œstrogène synthase)… |
| Métabolisme du glycogène |
| Glucose 6-phosphatase ; transporteur du glucose 6-phosphate (T1) ; transporteur du glucose (T2) ; transporteur du phosphate (T3) |
| Détoxification ; Métabolisme des médicaments, des vitamines liposolubles, des xénobiotiques et des acides gras polyinsaturés |
| NADPH cytochrome P-450 réductase; cytochromes P-450 |
| NADH cytochrome b5 réductase |
| Catabolisme de l’hémoglobine |
| Hème oxygénase |
| Métabolisme de la bilirubine |
| UDP glucuronosyltransférase |
| Stockage et signalisation du Ca2+ |
| Récepteur de l’inositol triphosphate |
| Régulation des ions Ca2+ et transport membranaire |
| Carboxylestérases (hydrolases A et B) |