Complexe de Golgi
« No cellular organelle has been the subject of as many, as long-lasting, or as diverse polemics as the Golgi apparatus. »
William Gordon Whaley
Une existence controversée
En 1865, Adolph J.H.F. von La Valette-Saint George, professeur d’anatomie à l’Université de Bonn, décrit le Nebenkörper (l’appareil de Golgi ?) dans les cellules sexuelles de l’escargot ; il observe son évolution au cours de la mitose et décrit sa reformation post-mitotique à partir d’une masse granulaire cytoplasmique. En 1896, Bartolomeo Camillo Emilio Golgi (Université de Pavie) cherche à mettre au point une technique de coloration du tissu nerveux ; essayant diverses méthodes d’imprégnation métallique, il décrit la « reazione nera » : les cellules nerveuses – axones et dendrites – sont colorées en noir par le nitrate d’argent. En 1898, dans des coupes de tissu nerveux de hibou et de chat, il découvre, à proximité du noyau et du centrosome, un « apparato reticolare interno ». En 1902, l’anatomiste Friedrich Kopsch améliore la technique de coloration de Golgi en introduisant une imprégnation à l’acide osmique (coloration mixte à l’osmium et au nitrate d’argent). L’appareil réticulaire interne est rebaptisé « appareil de Golgi » en 1909, puis « complexe de Golgi ». Camillo Golgi et Santiago Ramon y Cajal (Université de Barcelone) partagèrent le prix Nobel de physiologie ou médecine 1906 pour avoir caractérisé le quatuor de cellules de la neuroglie : astrocytes, oligodendrocytes, cellules microgliales et cellules épendymaires. La découverte d’un nouvel organite, le complexe de Golgi, passa inaperçue.
Références : Von La Valette-Saint George AJHF Ueber die Genese der Samenkörper (1865)
Golgi C Sulla struttura delle cellule nervose dei gangli spinali (1898)
Dans la citation citée en exergue, William G. Whaley rappelle que peu d’organites ont fait l’objet d’autant de controverses. J’y vois plusieurs raisons : (i) la technique d’imprégnation par les sels métalliques donnait des résultats difficilement reproductibles ; (ii) la structure du Golgi est complexe, associant saccules, vésicules, tubules ; ses limites avec les organites voisins sont difficiles à définir : où finit le reticulum endoplasmique ? où commence le Golgi ? Les débats entourant son existence et la terminologie à employer pour le désigner n’empêchèrent pas cet organite d’être l’objet d’un réel engouement. De l’abondante littérature qui lui fut consacrée dans les années suivant sa découverte, il ne subsiste à peu près rien qui soit digne d’intérêt. Au milieu du XXesiècle, un demi-siècle après sa découverte, des microscopistes aussi expérimentés que George Palade et Albert Claude (The Rockefeller Institute for Medical Research) soutenaient que l’appareil réticulaire était un artefact de coloration consistant en formations myéliniques. Dans une communication faite en 1954 à la Royal Society, Claude mettait en garde contre « some artefacts such as the Golgi apparatus » ! L’avènement du microscope électronique mit fin à la controverse : l’examen de coupes ultra-fines de cellules d’épididyme de rat imprégnées de sels métalliques, par Albert Dalton et Marie D. Felix (National Cancer Institute, National Institutes of Health), ou celles de pancréas de souris par Fritiof S. Sjöstrand et V. Hanzon (Department of Anatomy, Karolinska Institutet, Stockholm) révélèrent l’architecture caractéristique de l’appareil de Golgi: un empilement de sacs membranaires aplatis (appelés selon les auteurs : saccules, citernes, lamelles) entourés de vésicules. En hommage au travail de pionnier accompli par Albert Dalton, l’organite fut baptisé en 1956 « The Dalton complex ».
Références : Whaley WG The Golgi Apparatus (1975)
Palade GE, Claude A The nature of the Golgi apparatus; identification of the Golgi apparatus with a complex of myelin figures (1949)
Palade GE, Claude A The nature of the Golgi apparatus; parallelism between intercellular myelin figures and Golgi apparatus in somatic cells (1949)
Claude A Cell Morphology and the Organization of Enzymic Systems in the Cytoplasm (1954)
Farquhar MG, Palade GE The Golgi apparatus (complex)-(1954–1981)-from artifact to center stage (1981)
Dalton AJ, Felix MD Studies on the Golgi substance of the epithelial cells of the epididymis and duodenum of the mouse (1953)
Dalton AJ, Felix MD Cytologic and cytochemical characteristics of the Golgi substance of epithelial cells of the epididymis in situ, in homogenates and after isolation (1954)
Sjöstrand FS, Hanzon V Ultrastructure of Golgi apparatus of exocrine cells of mouse pancreas (1954)
Dalton AJ, Felix MD A comparative study of the Golgi complex (1956)
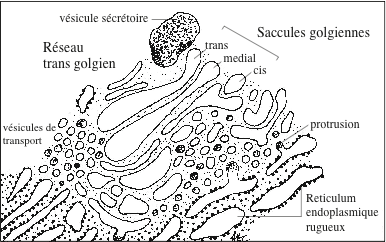
Le complexe de Golgi est présent dans toutes les cellules eucaryotes, animales et végétales ; il est particulièrement développé dans les cellules à forte activité sécrétoire comme les cellules de l’épididyme ou du pancréas exocrine. Si la morphologie microscopique d’organites comme le noyau ou les mitochondries est bien définie et reconnaissable, ce n’est que partiellement le cas pour le Golgi. Les premières observations ont établi (i) que le Golgi est généralement situé à proximité du noyau et du centrosome, entre le reticulum endoplasmique et la membrane plasmique ; cela est particulièrement le cas dans les cellules des glandes du tube digestif, dont la sécrétion est concentrée à un pôle de la cellule ; (ii) que le Golgi possède une polarité cis-trans, décrite en 1957 chez les flagellés par Pierre-Paul Grassé (Université de Paris) et, en 1963, chez les végétaux par Hilton H. Mollenhauer et Gordon Whaley (The Plant Research Institute, The University of Texas, Austin). La structure golgienne la plus facilement reconnaissable est l’empilement de citernes appelé « dictyosome » ; sa forme varie avec le type cellulaire : des citernes de forme ovale agencées en panier (cellules de l’épididyme) ; un réseau de rubans allongés (cellules des acini pancréatiques) ; une cage sphérique (cellules de l’hypophyse antérieure). Au sein du dictyosome, l’examen au microscope électronique et l’usage de réactifs cytochimiques ont conduit à distinguer des saccules cis, médianes et trans. Les autres structures golgiennes identifiées sont des tubules, des vésicules (50 à 100 nm) et des microvésicules (5 à 10 nm).
Références : Gatenby JB The Golgi apparatus of the living sympathetic ganglion cell of the mouse, photographed by phase-contrast microscopy (1953)
Whaley WG, Mollenhauer HH, Kephart JE The Endoplasmic Reticulum and the Golgi Structures in Maize Root Cells (1959)
Mollenhauer HH, Zebrun W Permanganate fixation of the Golgi complex and other cytoplasmic structures of mammalian tests (1960)
Mollenhauer HH, Whaley WG An observation on the functioning of the Golgi apparatus (1963)
Friend DS, Murray M Osmium impregnation of the Golgi apparatus (1965)
Cunningham WP, Morré DJ, Mollenhauer HH Structure of isolated plant Golgi apparatus revealed by negative staining (1966)
La première tentative de reconstruction tridimensionnelle du Golgi fut entreprise par Albert Claude (Institut Bordet, Bruxelles) dans les années 1970. Il examina au microscope électronique à transmission des coupes sériées – 200 coupes de 50 à 100 nanomètres d’épaisseur par cellule mais il ne disposait pas, à l’époque de logiciels d’imagerie informatiques pour intégrer les données en une reconstitution fiable. L’examen au microscope électronique à balayage (Scannig Electron Microscopy) a permis d’obtenir, à partir de coupes en série imprégnées à l’acide osmique, des images à haute résolution du Golgi de cellules d’épididyme de rat, d’acini pancréatiques, de cellules gonadotropes du lobe antérieur de l’hypophyse. Des progrès significatifs ont été accomplis dans la préservation de l’architecture délicate de cet organite ; les techniques de fixation bannissent l’utilisation de produits chimiques agressifs. L’échantillon biologique est congelé dans l’azote liquide (-150°C) sous haute pression (plus de 2000 bars) pour éviter la formation de cristaux aqueux ; l’eau est ensuite remplacée par de la résine, infiltrée à basse température(-90°C) ; après durcissement de la résine, les coupes sont préparées par cryo-ultra microtomie. Elles peuvent être examinées en microscopie photonique à super-résolution (qui permet de franchir la limite de résolution de 200 nm des microscopes optiques conventionnels) ; ou par microscopie électronique à transmission. Des images tridimensionnelles jusqu’à une résolution nanométrique, ont été obtenues par l’usage (i) de techniques stéréoscopiques sur coupes ultra-fines (100 nanomètres), ou sur coupes épaisses sous très hautes tensions, jusqu’à 3.000.000 de volts (Alain Rambourg, CEA, Saclay) ; (ii) de la tomographie électronique associée à la microscopie électronique (dual-axis electron microscope tomography). Kathryn Howell (Department of Cellular and Structural Biology, The University of Colorado School of Medicine Denver) et Richard McIntosh (Laboratory of Three-Dimensional Fine Structure, University of Colorado) ont obtenu par tomographie tridimensionnelle une reconstruction très détaillée de cellules épithéliales de rein de rat (cellules NRK).
Références : Claude A Interrelation of cytoplasmic membranes in mammalian liver cells : Endoplasmic reticulum and Golgi complex (1968)
Rambourg A, Clermont Y, Chrétien M Tridimensional analysis of the formation of secretory vesicles in the Golgi apparatus of absorptive columnar cells of the mouse colon (1989)
Rambourg A, Clermont Y Three-dimensional electron microscopy: structure of the Golgi apparatus (1990)
Ladinsky MS, Mastronarde DN, McIntosh JR, Howell KE, Staehelin LA Golgi structure in three dimensions: functional insights from the normal rat kidney cell (1999)
L’attention s’est particulièrement portée sur les deux réseaux membranaires encadrant les citernes médianes du dictyosome : la citerne cis est associée à une structure appelée « réseau cis-golgien » (Cis Golgi Network), formée par l’agrégation de vésicules issues par bourgeonnement du reticulum endoplasmique. La citerne trans fait partie d’une structure complexe : le « réseau trans-golgien » (Trans Golgi Network). Autre point qui a mobilisé l’attention des chercheurs : le dictyosome est-il une structure unique dont les citernes sont reliées entre elles par des connexions tubulaires ? De telles connexions ont été décrite de façon convaincante : (i) dans les cellules ß de souris secrétant de l’insuline après stimulation par du glucose (Kathryn Howell). (ii) dans les spermatides de rat (Alain Rambourg). L’existence de connexions permanentes entre citernes pose le problème de savoir comment, dans ces conditions, les citernes parviennent à conserver leur individualité biochimique et enzymatique.
Références : Clermont Y, Rambourg A, Hermo L Connections between the various elements of the cis- and mid-compartments of the Golgi apparatus of early rat spermatids (1994)
Clermont Y, Rambourg A, Hermo L Trans-Golgi network (TGN) of different cell types: three-dimensional structural characteristics and variability (1995)
Marsh BJ, Volkmann N, McIntosh JR, Howell KE Direct continuities between cisternae at different levels of the Golgi complex in glucose-stimulated mouse islet beta cells (2004)
Trucco A, Polishchuk RS, Martella O, Di Pentima A, Fusella A, Di Giandomenico D, San Pietro E, Beznoussenko GV, Polishchuk EV, Baldassarre M, Buccione R, Geerts WJC, Koster AJ, Burger KNJ, Mironov AA, Luini A Secretory traffic triggers the formation of tubular continuities across Golgi sub-compartments (2004)
Dès les années 1960, on a établi qu’en plus d’une hétérogénéité morphologique le Golgi présente une hétérogénéité biochimique ; le cis-Golgi fixe spécifiquement le marquage par l’osmium (Daniel S. Friend et Michael J. Murray, Department of Pathology, University of California School of Medicine, San Francisco). La réaction de Gomori ayant été adaptée à la microscopie électronique, on a détecté la présence de phosphatases – thiamine pyrophosphatase, nucléoside diphosphatase et cytidine monophosphatase – dans les saccules du trans-Golgi (Alex Novikoff et Sydney Goldfisher, Albert Einstein College of Medicine), et d’adénine dinucléotide phosphatase dans les saccules médianes des améloblastes de rat – les cellules qui fabriquent l’émail dentaire – (C.F. Smith, 1986, Department of Anatomy, Faculty of Dentistry, McGill University).
Références : Friend DS, Murray M Osmium impregnation of the Golgi apparatus (1965)
Novikoff AB, Goldfisher S Nucleosidediphosphatase activity in the Golgi apparatus and its usefulness for cytological studies (1961)
Goldfisher S, Essner E, Novikoff AB The localization of phosphatase activities at the level of ultrastructures (1964)
Rambourg A, Clermont Y, Marraud A Three-dimensional structure of the osmium-impregnated Golgi apparatus as seen in the high voltage electron microscope (1974)
Complexe de Golgi et sécrétion
Les travaux de Santiago Ramon y Cajal sur les cellules caliciformes de l’intestin, et plus tard ceux de Nassonov (Laboratorium des Abteiles für algemeine Morphologie, Leningrad) sur les muqueuses des glandes d’amphibien et les cellules pancréatiques ont établi un lien entre cette structure et la sécrétion cellulaire.
Références : Ramon y Cajal S Algunas variaciones ficiologica y pathologica del apparato reticular de Golgi (1914)
Nassonov DN Das Golgische Binnennetz und seine Beziehungen zu der Sekretion. Untersuchugen über einige Amphibiendrüsen (1923)
Le pancréas est un organe à activité sécrétoire élevée. Cette glande annexe du tube digestif (duodénum) est formée de tissu exocrine (85% de la masse de l’organe), et de tissu endocrine (3% de la masse). Deux types de cellules composent les îlots de Langherans du tissu endocrine : (i) les cellules β, majoritaires (50 à 70% des cellules de l’îlot) synthétisent et exportent l’insuline, l’amyline (Islet Amyloid Polypeptide), la protéine C… ; (ii) les cellules α synthétisent le glucagon et la somatostatine. La glande exocrine est constituée d’acinis de cinq à dix cellules qui synthétisent et exportent des enzymes, le plus souvent sous forme de précurseurs inactifs. Après activation dans l’intestin grêle, les proenzymes deviennent des enzymes actifs digérant les acides nucléiques (DNAse, RNAse), les protéines (trypsinogène, chymotrypsinogène, procaboxy peptidases, élastase), les lipides (lipase, phospholipase A2) et les hydrates de carbone (amylase). Les cellules acineuses sont polarisées : le noyau et le reticulum endoplasmique occupent la portion basale ; le Golgi et les granules de sécrétion (grains de zymogènes) occupent le pôle apical. Les sécrétions pancréatiques sont déclenchées par stimulation hormonale et sous influence nerveuse et nutritionnelle. Le contenu des granules de sécrétion se déverse au pôle apical de la membrane plasmique dans des canalicules aboutissant au canal pancréatique (canal de Wirsung) et à la portion antérieure de l’intestin grêle (duodénum). C’est dans les cellules des acini pancréatiques que George Palade (Rockefeller University), à la fin des années 1960, mit en évidence l’existence de la voie sécrétoire. Avec James Jamieson, ils pratiquèrent des expériences de radio-marquage (pulse chase experiments) : après injection d’acides aminés radioactifs à des cobayes, le pancréas était prélevé à différentes périodes de temps après injection ; sur des fragments de tissu fixés à la glutaraldéhyde et coupés au microtome, l’autoradiographie révéla le trajet des traceurs radioactifs du reticulum endoplasmique au complexe de Golgi puis aux grains de zymogène, où les proenzymes s’accumulent avant leur exportation dans le tractus digestif.
Références : Jamieson JD, Palade GE Role of the Golgi complex in the intracellular transport of secretory proteins (1966)
Jamieson JD, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. I. Role of the peripheral elements of the Golgi complex (1967)
Jamieson JG, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. II. Transport to Condensing Vacuoles and Zymogen Granules (1967)
Dix ans plus tard, Randy Schekman (University of California, Berkeley) et son étudiant, Peter Novick, découvrirent les mutants des gènes SEC chez la levure Saccharomyces cerevisiae. En utilisant ces mutants, dont la croissance est sensible à la température, ils disséquèrent les étapes successives de la voie sécrétoire. Ils découvrirent, par examen au microscope électronique, que chez les mutants sec 1 les produits de sécrétion (phosphatase acide, invertase) s’accumulent dans la cellule lorsque le milieu de culture passe de la température « permissive » à une température plus élevée ; des vésicules de sécrétion s’accumulent entre le Golgi et la membrane plasmique. Novick et Schekman ont caractérisé 23 gènes SEC dont les produits sont des régulateurs de la voie sécrétoire. Au cours de la seule étape de transition entre le Golgi et la membrane plasmique, ils ont mis en évidence l’intervention des produits de dix gènes SEC. Dans leur approche expérimentale, ils utilisèrent la technique des doubles mutants. En 1946, Theodosus Dobzhansky, l’un des fondateurs de la Théorie synthétique de l’évolution, a introduit la notion de « létalité synthétique » : c’est un cas de mort cellulaire résultant de la mutation de deux gènes différents alors que la mutation d’un seul de ces deux gènes n’affecte pas la létalité. Si l’on réunit dans un double mutant les allèles de gènes, fonctionnels lorsqu’ils sont séparés et qui cessent de l’être dans le double mutant, cela peut être interprété comme indiquant que les produits de ces gènes interviennent dans la même voie métabolique et même dans la même étape de cette voie. Pour chaque mutation sec, Novick et Schekman ont sélectionné un ou des allèles sensibles à la température. C’est grâce à la technique des double-mutants qu’ils ont pu mettre en évidence des interactions entre gènes impliqués dans des étapes similaires de la voie sécrétoire et découvrir de nouvelles interactions. Novick et Schekman ont utilisé la centrifugation en gradient de densité pour séparer les cellules de la souche sauvage des cellules sec mutées ; le blocage de la voie sécrétoire se traduit, chez les mutants, par une accumulation de membranes qui augmente la densité d’équilibre des cellules mutées (plus « lourdes »). Ils ont établi la séquence des étapes de la voie sécrétoire chez la levure : (i) formation de vésicules transportant du matériel cargo à partir du reticulum endoplasmique ; (ii) fusion des vésicules avec le cis-Golgi ; (iii) transport antérograde des citernes du cis-Golgi vers le trans-Golgi ; (iv) fusion des vésicules issues du trans-Golgi avec la membrane plasmique. Pour la petite histoire, il est intéressant de savoir que les National Institutes of Health ont rejeté la première demande de financement de Randy Schekman sous le prétexte qu’il n’avait pas les connaissances requises pour entreprendre des recherches sur la sécrétion.
Références : Jamieson JG, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. IV. Metabolic requirement (1968)
Novick P, Schekman R Secretion and cell-surface growth are blocked in a temperature-sensitive mutant of Saccharomyces cerevisiae (1979)
Novick P, Field C, Schekman R Identification of 23 complementation groups required for post-translational events in the yeast secretory pathway (1980)
Novick P, Ferro S, Schekman R Order of events in the yeast secretory pathway (1981)
Kaiser CA, Schekman R Distinct sets of SEC genes govern transport vesicle formation and fusion early in the secretory pathway (1990)
Finger FP, Novick P Synthetic Interactions of the Post-Golgi sec Mutations of Saccharomyces cerevisiae (2000)
Dobzhansky T. Genetics of natural populations. XIII. Recombination ad variability in populations of Drosophila pseudoobscura (1946)
Isoler le complexe de Golgi
La première approche expérimentale utilisée pour définir la composition biochimique du complexe de Golgi fut celle du fractionnement subcellulaire par centrifugation différentielle et en gradient de densité. L’obtention de préparations purifiées ne fut pas aisée, s’agissant d’un composant mineur de la cellule : environ 1% de la masse des protéines cellulaires dans les hépatocytes contre 10% pour le noyau, 20% pour les mitochondries. En 1954 et 1959, Edward Kuff, Walter Schneider et Albert Dalton utilisèrent la centrifugation différentielle combinée à la centrifugation en gradient de densité pour purifier l’appareil de Golgi d’épididyme de rat (très développé dans les cellules endocrines). Les auteurs se contentèrent de critères morphologiques pour caractériser la fraction purifiée, des critères d’autant moins fiables que le broyage des tissus désagrège l’organite. Ce n’est qu’en 1964 que les botanistes Hilton H. Mollenhauer et James D. Morré résolurent cette difficulté : la morphologie et la polarité cis-trans du complexe sont conservées en traitant les tissus à la glutaraldéhyde et en ajoutant un cation divalent (du calcium) au milieu d’homogénéisation (une solution de saccharose et de dextran). La même année, Sidney Goldfischer, E. Essner et Alex Novikoff (Albert Einstein College of Medicine) mirent au point un test histochimique révélant en microscopie la présence de thiamine pyrophosphatase, un « enzyme marqueur » du Golgi.
Références : Morré DJ, Mollenhauer HH Isolation of Golgi apparatus from plant cells (1964)
Morré DJ, Mollenhauer HH, Chambers JE Glutaraldehyde stabilization as an aid to Golgi apparatus isolation (1965)
Morré DJ, Hamilton RL, Mollenhauer HH, Lequire VS Isolation of a Golgi apparatus-rich fraction from rat liver. I. Method and morphology (1970)
Ehrenreich JH, Bergeron JJM, Siekevitz P, Palade GE Golgi Fractions Prepared from Rat Liver Homogenates I. Isolation Procedure and Morphological Characterization (1973)
En 1968, Mary-Jane Spiro et Robert G. Spiro (Glycoproteins and Biomembranes Research Laboratory, Joslin Diabetes Center and Harvard Medical School) isolèrent à partir de « particules » de glande thyroïde, une sialyltransférase catalysant le transfert d’acide sialique, à partir de cytidine monophosphate N-acétylneuraminique acide sur des glycopeptides et des glycoprotéines possédant un galactose en position terminale de leur chaîne glycanique. Le précurseur des hormones thyroïdiennes, la thyroglobuline, est une glycoprotéine dont la chaîne glycanique contient, entre autres sucres, du galactose et de l’acide sialique. La même année, une galactosyltransférase fut identifiée dans le lait ; le nucléotide donneur de galactose était l’UDP-galactose ; l’accepteur de galactose était la N-acétyl glucosamine. En 1969, Rebecca Fleischer, Sidney Fleisher et Hidehiro Ozawa (Department of Molecular Biology, Vanderbilt University) purifièrent le complexe de Golgi de foie de bœuf par centrifugation zonale. Cet organe volumineux fournissait suffisamment de matériel pour effectuer des analyses biochimiques sur la préparation purifiée (le Golgi ne représente qu’une faible proportion des protéines de la cellule). La préparation purifiée ne contenait que 0,2% de l’activité galactosyltransférase de l’homogénat – elle n’était que très faiblement représentative du Golgi – mais l’activité enzymatique était enrichie 40 fois par rapport à l’homogénat. Dans l’article publié dans le Journal of Cell Biology Rebecca Fleisher conclut que l’UDP galactose :N-acétyl glucosamine galactosyltransférase est localisée dans le complexe de Golgi. La présence de glycosyltransférases dans cet organite fut confirmée par différents groupes de chercheurs.
Références : Spiro MJ, Spiro RG Glycoprotein Biosynthesis: Studies on Thyroglobulin (1968)
Fleisher B, Fleisher S, Ozawa H Isolation and characterization of Golgi membranes from bovine liver (1969)
Le pathologiste et pionnier de l’histochimie, Joseph F.A. McManus, a mis au point, au début des années 1940, la méthode de coloration à l’acide périodique et au réactif de Schiff qui révèle la présence de groupes aldéhydiques ; en 1948, il mit en évidence la présence de glycoprotéines dans le tissu rénal. Charles P. Leblond (Department of Anatomy, McGill University, Montréal ) et ses collaborateurs entreprirent une série d’observations dont les résultats permirent de préciser la fonction du Golgi : (i) en 1950, Leblond observa un marquage de cet organite sur des coupes d’épithélium intestinal colorées par la technique de McManus, révélant ainsi la présence de sucres. Des observations similaires furent faites dans l’hypophyse, le rein et la thyroïde. (ii) En 1964, avec Marian Peterson, ils avancèrent l’hypothèse que le Golgi est le site de glycosylation des protéines. (iii) Avec Alain Rambourg et William Hernandez, ils adaptèrent la coloration à l’acide périodique et au réactif de Schiff à la microscopie électronique, sur des coupes de tissus préalablement soumises à une digestion par l’α-amylase pour éliminer le glycogène présent dans les cellules ; ils observèrent un gradient de coloration allant du cis-Golgi au trans-Golgi. (iv) Leblond et Marian Neutra formulèrent l’hypothèse que les glycoprotéines subissent une maturation dans le Golgi, avec addition séquentielle de sucres d’une citerne à la suivante.
Références : Leblond CP Distribution of periodic acid reactive carbohydrates in the adult rat (1950)
Peterson M, Leblond CP Synthesis of complex carbohydrates in the Golgi region, as shown by radioautography after injection of labeled glucose (1964)
Rambourg A, Hernandez W, Leblond CP Detection of Complex Carbohydrates in the Golgi Apparatus of Rat Cells (1969)
Rambourg A, Hernandez W, Leblond CP Detection of periodic acid reactive carbohydrate in Golgi saccules (1969)
Autoradiographie
Les recherches sur l’incorporation de résidus glycosylés dans les polypeptides reçurent une impulsion décisive avec la mise à la disposition des chercheurs d’un nouvel outil : l’autoradiographie combinée à la microscopie électronique. Après la découverte de la radioactivité artificielle par les physiciens Irène Curie et Frédéric Joliot (tous deux prix Nobel de chimie en 1935), les isotopes radioactifs firent leur apparition dans les laboratoires. Frédéric Joliot prédit l’intérêt de ces isotopes en biologie expérimentale. En 1934, le bombardement d’iode avec les rayons α du polonium émis dans le cyclotron du Collège de France permit d’obtenir l’isotope 123I. Les premières tentatives de marquage d’une hormone thyroïdienne, la thyroxine, furent entreprises sous l’égide de Joliot. Antoine Lacassagne (Laboratoire de Synthèse Atomique, Paris) essaya d’incorporer du polonium 210Po dans la paroi intestinale d’un animal. En 1937, Charles Leblond essaya de marquer les hormones thyroïdiennes en injectant de l’iode radioactif (128I) à des animaux. La révélation se faisait par contact de coupes de tissu thyroïdien avec une émulsion photographique. Les résultats furent décevants en grande partie à cause de la brièveté de la demi-vie des radio-isotopes utilisés.
La production de radioéléments artificiels atteignit sa vitesse de croisière sous l’égide d’Enrico Fermi (Los Alamos National Laboratory, prix Nobel de physique en 1938). Le bombardement de molécules cibles par des neutrons produisit des isotopes du carbone (14C), du phosphore (32P) et du soufre (35S). Charles Leblond (McGill University, Montréal) reprit ses expériences de marquage, commencées au début des années 1940, avec un isotope de l’131I (demi-vie de 8 jours). Pour révéler le marquage, il disposait de plaques photographiques sensibles. Il parvint ainsi à montrer la présence des grains d’argent de l’émulsion photographique dans la zone des follicules thyroïdiens. La résolution étant faible (100 micromètres), le physicien Pierre Demers suggéra d’appliquer directement sur la coupe histologique l’émulsion photographique liquéfiée de la firme Eastman Kodak. La « coating technique » fut mise au point par Leblond, Léonard Bélanger, Rita Bogoroch et Beatrix Kopriwa. D’améliorations en perfectionnements on parvint, dans les années 1960, à l’autoradiographie semi-quantitative à haute résolution, permettant de localiser avec précision la position des grains d’argent et de les compter sur une émulsion d’épaisseur calibrée.
Références : Leblond CP, Sue P Passage de l’iode radioactif (I128) dans la thyroïde stimulée par l’hormone thyréotrope de l’hypophyse (1940)
Leblond CP Localization of newly administered iodine in the thyroid gland as indicated by radioiodine (1943)
Leblond CP, Bélanger LF A method for locating radioactive elements in tissues by covering histological sections with a photographic emulsion (1946)
Kopriwa BM A semiautomatic instrument for the radioautographic coating technique (1966)
Dans les cellules eucaryotes, la moitié des protéines sont des glycoprotéines portant au moins une chaîne oligosaccharidique (glycane) liée par une liaison covalente à un résidu d’acide aminé. La taille du glycane est limitée et sa séquence est non-répétitive. On distingue des protéines N-glycosylées, où le glycane est lié par une liaison β-N-osidique à un résidu asparagine (Asn) ; et des protéines O-glycosylées ou le glycane est lié par une liaison α-O-osidique à un acide aminé hydroxylé (sérine, thréonine, tyrosine, hydroxyproline, hydroxylysine). Dans les cellules, il existe des N-glycanes de type oligomannoside et des N-glycanes de type complexe. La portion interne du N-glycane est un pentasaccharide lié par une de ses extrémités à une Asn ; à l’autre extrémité sont branchées des ramifications périphériques variables en nombre et en longueur. Il existe une grande variété de glycoprotéines.
La maîtrise de l’autoradiographie quantitative permit à Charles Leblond et coll. (Department of Anatomy, McGill University, Montréal) d’étudier le site d’incorporation de sucres marqués au tritium dans des cellules de la muqueuse de l’intestin grêle, du thymus ou du rein, de rat ou de souris. Marian Neutra et Charles Leblond injectèrent du 3H-galactose et du 3H-glucose à des rats et étudièrent leur devenir dans des cellules à forte activité sécrétrices (chondrocytes du cartilage, cellules caliciformes de la muqueuse intestinale…) par autoradiographie et microscopie électronique. En 1966, ils montrèrent que le site d’incorporation du 3H-galactose et du 3H-glucose dans les glycoprotéines est le complexe de Golgi.
Références : Neutra M, Leblond CP Radioautographic comparison of the uptake of galactose-H3 and glucose-H3 in the golgi region of various cells secreting glycoproteins or mucopolysaccharides (1966)
Neutra M, Leblond CP Synthesis of the carbohydrate of mucus in the golgi complex as shown by electron microscope radioautography of goblet cells from rats injected with glucose-H3 (1966)
L’utilisation de galactose dans les expériences effectuées par Neutra et Leblond présente un inconvénient : il peut être converti en glucose et incorporé dans le glycogène, ce qui complique l’interprétation des résultats. Gary C. Bennett et Leblond remplacèrent le galactose par du 3H-fucose, qui possède un groupe méthyle en C6 à la place du groupe hydroxyle du galactose. Le fucose est incorporé, à partir de GDP-fucose, par des fucosyl-transférases dans des N-glycanes, O-glycanes et des glycolipides. Bennett montra que l’incorporation des sucres dans les glycoprotéines intégrales de la membrane plasmique des cellules des tubules rénaux se fait d’abord dans le Golgi, avant de migrer du Golgi à la surface de la cellule.
Références : Bennett G, Leblond CP Formation of cell coat material for the whole surface of columnar cells in the rat small intestine, as visualized by radioautography with L-fucose-3H (1970)
Bennett GC Synthesis and migration of glycoproteins in cells of the rat thymic medulla, as shown by radioautography after 3H-fucose injection (1975)
Haddad A, Bennett G, Leblond CP Formation and turnover of plasma membrane glycoproteins in kidney tubules of young rats and adult mice, as shown by radioautography after an injection of 3H-fucose (1977)
Sites de glycosylation
Vers le milieu des années 1960, les biochimistes cherchèrent à identifier le ou les sites subcellulaires de glycosylation des protéines. La partie polypeptidique des glycoprotéines est-elle synthétisée par les ribosomes libres ou par les ribosomes liés au reticulum endoplasmique ? La partie oligosaccharidique des glycoprotéines est-elle incorporée au cours de la synthèse du polypeptide par les ribosomes ou dans un autre site qui restait à découvrir ? L’oligosaccharide est-il préalablement lié à des acides aminés spécifiques sous forme d’aminoacides-oligosaccharides, qui sont ensuite incorporés dans le polypeptide en cours de synthèse sur les ribosomes. Dans les expériences conduites par Edward J. Sarcione (Roswell Park Memorial Institute, Buffalo) sur des microsomes de foie de rats, préalablement perfusés avec des solutions contenant du 14C-galactose ou de la 3H-leucine (ou les deux), le marquage par la 3H-leucine se retrouvait dans la sous-fraction contenant les ribosomes et le marquage par le 14C-D-galactose ou le 14C-D-mannose dans la sous-fraction renfermant les protéines membranaires. L’incorporation de sucres pendant la synthèse du polypeptide sur les ribosomes fut mise en évidence par G. Ross Lawford et Harry Schachter (Department of Biochemistry, University of Toronto) ; une certaine proportion de 14C-glucosamine est incorporée dans le polypeptide en cours d’élongation par les ribosomes liés à la membrane. Des observations similaires, toujours avec la 14C-glucosamine, furent décrites par Janos Molnar, G.B. Robinson et Richard J. Winzler (Department of Biological Chemistry, University of Illinois College of Medicine) et par T. Hallinan et coll. (Department of Biochemistry, University of Sydney).
Une observation intéressante fut rapportée par Ronald R. Wagner et Morris A. Cynkin (Tufts University School of Medicine) : le taux de transfert de la 14C-glucosamine est plus élevé dans les microsomes lisses de foie de rat que dans les microsomes rugueux. Avec Henri Beaufay et coll, nous avons montré que par centrifugation différentielle de microsomes de foie de rat, le Golgi migre avec les microsomes lisses dérivant de la fragmentation du reticulum endoplasmique pendant le broyage des tissus. Colvin M. Redman ( New York Blood Center) montra que les protéines du sérum, qui sont pour la plupart des glycoprotéines, sont synthétisées par les polysomes liés au reticulum endoplasmique des cellules hépatiques. Redman et M. George Cherian montrèrent que les sucres sont ajoutés au polypeptide après décharge vectorielle complète dans les vésicules microsomiales, c’est-à-dire après que le polypeptide ait franchi la barrière membranaire ; il existe au moins deux sites d’incorporation des sucres au polypeptide : les microsomes rugueux pour la N-acétylglucosamine et le mannose et les microsomes lisses pour le galactose.
Références : Sarcione EJ The Initial Subcellular site of Incorporation of Hexose into Liver Protein (1964)
Sarcione EJ, Carmody PJ Incorporation of D-galactose into liver microsomal protein in vitro (1966)
Lawford GR, Schachter H Biosynthesis of Glycoprotein by Liver: The Incorporation in vivo of 14C-Glucosamine into Protein-bound Hexosamine and Sialic Acid of Rat Liver Subcellular Fractions (1966)
Molnar J, Robinson GB, Winzler RJ Biosynthesis of glycoproteins IV. The subcellular sites of incorporation of glucosamine-1-14C into glycoprotein in rat liver (1964)
Hallinan T, Murty CN, Grant JH The exclusive function of reticulum bound ribosomes in glycoprotein biosynthesis (1968)
Beaufay H, Amar-Costesec A, Thinès-Sempoux D, Wibo M, Robbi M, Berthet J Analytical Study of Microsomes and Isolated Subcellular Membranes from Rat Liver. III. Subfractionation of the Microsomal Fraction by Isopycnic and Differential Centrifugation in Density Gradients (1974)
Redman CM The synthesis of serum proteins on attached rather than free ribosomes of rat liver (1968)
Wagner RR, Cynkin MA The Incorporation of 14C-glucosamine from UDP-N-acetyl-14C-glucosamine into liver microsomal protein in vitro (1969)
Redman CM, Cherian MG The Secretory Pathways of Rat Serum Glycoproteins and Albumin. Localization of Newly Formed Proteins within the Endoplasmic Reticulum (1972)
J’ai évoqué, dans un paragraphe précédent, les difficultés éprouvées par les premiers chercheurs qui tentèrent de purifier le Golgi. Au début des années 1970, les difficultés techniques ayant été résolues, on entreprit d’établir la composition enzymatique du Golgi. Après le travail de Rebecca et Sidney Fleischer et Hideiro Ozawa (Department of Molecular Biology, Vanderbilt University) qui montrèrent de façon plus ou moins convaincante la présence de galactosyl-transférase dans le Golgi de foie de bœuf, Harry Schachter et coll (Department of Biochemistry, University of Toronto) ont décrit la présence, dans le Golgi de foie de rat, de sialyl-transférase, galactosyl-transférase et N-acétylglucosaminyl-transférase – les trois glycosyl-transférases catalysant le transfert du trisaccharide terminal de la chaîne oligosaccharidique de nombreuses glycoprotéines. Les résultats d’autres travaux de ce type montrèrent la présence dans le Golgi d’enzymes catalysant le transfert de fucose sur la N-acétylglucosamine (N-glycosylation).
Références : Schachter H, Jabbal L, Hudgin RL, Pinteric L, McGuire EJ, Roseman S Intracellular localization of liver sugar nucleotide glycoprotein glycosyltransferases in a Golgi-rich fraction (1970)
Wibo M, Godelaine D, Amar-Costesec A, Beaufay H Subcellular Location of Glycosyltransferases in Rat Liver (1975)
Ravoet AM, Amar-Costesec A, Beaufay H Topology of Mannosyltransferase, Glucosyltransferase and N-acetylglucosamine Phosphotransferase in rat liver (1982)
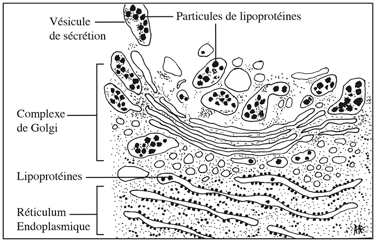
Le fait que la synthèse de la chaîne oligosaccharidique des glycoprotéines se fait par addition séquentielle de sucres devait se refléter dans la répartition des oligosaccharyl-transférases entre les différents compartiments golgiens, du cis- au trans-Golgi. Différents groupes de chercheurs tentèrent de mettre en évidence cette hétérogénéité enzymatique du Golgi en le sous-fractionnant et en séparant les sous-fractions par centrifugation différentielle et en gradient de densité. Pour qu’une approche expérimentale de ce type soit couronnée de succès, il faut qu’existent entre les entités golgiennes des différences de taille (séparation par centrifugation différentielle) ou de densité d’équilibre dans le gradient utilisé (séparation par centrifugation en gradient de densité). L’existence de telles différences entre les composants vésiculaires, tubulaires ou sacculaires n’a pas été démontrée. On crut avoir trouvé une solution en chargeant les vésicules golgiennes en lipoprotéines de très faible densité. C’est le cas chez les rats auxquels on administre de l’éthanol par intubation stomacale. Cette charge des vésicules en lipoprotéines offre un double avantage : (i) les lipoprotéines, denses aux électrons, servent de marqueur morphologique en microscopie électronique en transmission ; (ii) les lipoprotéines modifient la densité d’équilibre des vésicules en la diminuant. John H. Ehrenreich, John J. Bergeron et George E. Palade (The Rockefeller University, New York) appliquèrent cette approche pour étudier la distribution de l’UDP-galactose: N-acétyl-glucosamine galactosyltransférase entre trois sous-fractions, et montrer que cet enzyme est inséré dans la membrane. Albert Claude a observé, au microscope électronique en transmission, que les vésicules sécrétoires dans lesquelles s’accumulent les lipoprotéines de très faible densité ont un diamètre de 400 Å et sont localisées dans le trans-Golgi. Hilton Mollenhauer et coll. établirent la distribution de la galactosyl-transférase entre des sous-fractions de Golgi de foie de rat : vésicules, tubules lisses et saccules (citernes). William D. Meritt et D. James Morré (Department of Biological Sciences, Purdue University, Lafayette) ont montré que la galactosyl-transférase est présente dans les fractions légères du gradient, riches en vésicules du trans-Golgi chargées de lipoprotéines de très faible densité. Ces résultats ne manquent pas d’intérêt mais ils étaient loin d’être concluants ; pour résoudre le problème de la localisation de toutes les glycosyl-transférases golgiennes parmi les différents compartiments il fallait recourir à d’autres approches expérimentales.
Références : Bergeron J, Palade GE, Siekevitz P Cell Fractionation Golgi bottom fraction (1970)
Claude A Growth and Differentiation of Cytoplasmic Membranes in the Course of Lipoprotein Granule Synthesis in the Hepatic Cell I. Elaboration of Elements of the Golgi Complex (1970)
Ovtracht L, Morré DJ, Cheetham, Mollenhauer HH Subfractionation of Golgi apparatus from rat liver: method and morphology (1973)
Ehrenreich JH, Bergeron JJ, Siekevitz P, Palade GE Golgi fractions prepared from rat liver homogenates. I. Isolation procedure and morphological characterization (1973)
Bergeron JJ, Ehrenreich JH, Siekevitz P, Palade GE Golgi fractions prepared from rat liver homogenates. II. Biochemical characterization (1973)
Merrit WD, Morré DJ A glycosyltransferase of high specific activity in secretory vesicles from isolated Golgi apparatus of rat liver (1973)
Intermédiaires lipidiques
Luis F. Leloir reçut une solide formation de biochimiste à Cambridge, dans le laboratoire de Frederick Gowland Hopkins (prix Nobel de physiologie ou médecine 1929), à Saint Louis, chez Carl F. Cori (prix Nobel de physiologie ou médecine 1947), et dans le laboratoire de David E. Green à Columbia University. En Argentine, Leloir étudia le mode d’assemblage des disaccharides : tréhalose (glucose + glucose) et saccharose (glucose + fructose), et du polysaccharide : glycogène, la forme de stockage du glucose dans les cellules animales, chez certains mycètes et certaines bactéries. En 1948, Leloir constata que pour être transféré sur un autre sucre, le glucose doit être « activé », c’est-à-dire lié à un nucléotide sous forme d’uridine diphospho-glucose (UDP-O-Glc). A la suite de cette découverte, la recherche d’autres nucléotides donneurs de sucres conduisit, dans les années 1950, à la caractérisation d’uridine diphospho-N-acétylglucosamine (UDP-GlcNac), de guanosine diphospho-mannose (GDP-Man) ; d’adénosine diphospho-glucose (ADP-Glc), le donneur de glucose pour la synthèse de l’amidon, la forme de stockage du glucose chez les végétaux chlorophylliens. Ces nucléotides-sucres sont présents dans le cytosol des cellules. Leloir reçut en 1970 le prix Nobel de chimie pour avoir décrit avec Carlos E. Cardini la voie biosynthétique du glycogène (Uridine-diphospho glucose Pathway).
Références : Cardini CE, Paladini AC, Caputto R, Leloir LF Uridine Diphosphate Glucose: The Coenzyme of the Galactose–Glucose Phosphate Isomerization (1950)
Leloir LF The enzymatic transformation of uridine diphosphate glucose into a galactose derivative (1951)
La membrane plasmique des bactéries est entourée d’une enveloppe renfermant des peptidoglycanes. En 1967, Yasushi Higashi, Jack L. Strominger et Charles C. Sweeley (Molecular and Cellular Biology, Harvard University) découvrirent que chez Staphylococcus micrococcus et chez Salmonella le franchissement de la membrane plasmique par les sucres met en jeu des intermédiaires lipidiques phosphorylés, formés d’une longue chaîne hydrocarbonée, comme le poly-terpénoïde bactoprénol : C55H92O. En 1968, Malka Scher M, W.J. Lennarz et Charles C. Sweeley (Department of Physiological Chemistry, John Hopkins University School of Medicine, Baltimore) ont isolé de Micrococcus lysodeikticus un poly-isoprénoïde alcool en C55, formé par l’association de 11 unités isoprène et terminé par un alcool. Outre l’assemblage des peptidoglycanes et des liposaccharides de la paroi bactérienne, ces intermédiaires lipidiques interviennent aussi dans l’assemblage des glycoprotéines membranaires des cellules eucaryotes et des glycoprotéines sécrétoires. L’oligosaccharide, dont l’assemblage a commencé sur la face cytosolique de la membrane du reticulum endoplasmique, doit franchir la barrière de la bicouche lipidique pour être transféré sur un accepteur polypeptidique. C’est là qu’interviennent des dérivés phosphorylés d’alcools à longues chaînes appelés poly-isoprénols. Dans les cellules eucaryotes, Luis Leloir et Nicolas H. Behrens (Instituto de Investigaciones Bioquímicas, Fundación Campomar, Buenos Aires) ont découvert le dolichol, le plus long lipide membranaire connu (jusqu’à 105 atomes de C), formé par l’association de 17 à 21 unités isoprène. Dans la membrane du reticulum endoplasmique, où il est présent sous forme d’ester phosphorique, il sert d’ancre lipidique pour l’assemblage des N-glycanes avant leur transfert dans le lumen du reticulum endoplasmique.
Références : Higashi Y, Strominger JL, Sweeley CC Structure of a lipid intermediate in cell wall peptidoglycan synthesis: a derivative of a C55 isoprenoid alcohol (1967)
Higashi Y, Strominger JL, Sweeley CC Biosynthesis of the Peptidoglycan of Bacterial Cell Walls XXI. Isolation of Free C55-Isoprenoid Alcohol and of Lipid Intermediates in Peptidoglycan Synthesis from Staphylococcus Aureus (1970)
Scher M, Lennarz WJ, Sweeley CC The biosynthesis of mannosyl-1-phosphoryl-polyisoprenol in Micrococcus lysodeikticus and its role in mannan synthesis (1968)
Behrens NH, Leloir L Dolichol Monophosphate Glucose: An Intermediate in Glucose Transfer in Liver (1970)
L’assemblage de l’oligosaccharide est un processus complexe appelé « cycle du dolichol». La première étape est le transfert de N-acétylglucosamine phosphate (P-GlcNAc) à partir d’un nucléotide-sucre :
Cette réaction est catalysée par un enzyme membranaire, l’UDP-N-acétylglucosamine : dolichol-phosphate N-acétylglucosamine-1-P transférase. Il a été séquencé par Xiaying Zhu et Mark A. Lehrman (Department of Pharmacology, University of Texas Southwestern Medical Center, Dallas) ; il possède plusieurs hélices transmembranaires et son site actif est situé sur la face cytosolique du reticulum endoplasmique. La liaison ester-diphosphate formée à l’issue de la réaction est riche en énergie ; c’est la phase d’« activation » du monosaccharide.
Références : Zhu XY, Lehrman MA Cloning, sequence, and expression of a cDNA encoding hamster UDP-GlcNAc: dolichol phosphate N-acetylglucosamine-1-phosphate transferase (1990)
Dan N, Middleton RB, Lehrman MA Hamster UDP-N-acetylglucosamine:dolichol-P N-acetylglucosamine-1-P transferase has multiple transmembrane spans and a critical cytosolic loop (1996)
L’assemblage de l’oligosaccharide des glycoprotéines sécrétoires ou membranaires commence sur la face cytosolique de la membrane du reticulum endoplasmique. Les donneurs de sucres sont des nucléotides ; l’accepteur est le dolichol phosphate, une ancre lipidique insérée dans la membrane. Les réactions de transglycosylation sont catalysées par des glycosyltransférases membranaires qui agissent séquentiellement : (i) la N-acétyl-glucosaminyl phospho-transférase mentionnée ci-dessus, un enzyme clé de la glycosylation des protéines ; (ii) une N-acétyl-glucosaminyltransférase qui a pour donneur l’UDP-GlcNAc et pour accepteur le Dol-PP-GlcNAc ; (iii) des mannosyltransférases qui ont pour donneur le GDP-Man et pour accepteur le Dol-PP-GlcNAc2. L’oligosaccharide intermédiaire :
subit une translocation à travers la bicouche phospholipidique de la membrane et migre de la face cytosolique à la face luminale du reticulum endoplasmique. L’enzyme impliqué est une flippase. L’existence d’enzymes de ce type avait été prédite par Mark S. Bretscher, pour expliquer la différence de composition en phospholipides entre les deux feuillets de la bicouche des membranes cellulaires. Sumana Sanyal, Christian G. Franck et Anant K. Menon (Department of Biochemistry, Weill Cornell Medical College, New York) ont montré que la membrane du reticulum endoplasmique contient au moins deux flippases ; ces enzymes ont été solubilisés en traitant des microsomes de Saccharomyces cerevisiae, par du Triton X-100 ; leur activité a été étudiée après reconstitution dans des protéoliposomes ; leur fonctionnement ne requiert pas la présence d’ATP.
Références : Sanyal S, Franck CG, Menon AK Distinct Flippases Translocate Glycerophospholipids and Oligosaccharide Diphosphate Dolichols across the Endoplasmic Reticulum (2008)
Sanyal S, Menon AK Specific transbilayer translocation of dolichol-linked oligosaccharides by an endoplasmic reticulum flippase (2009)
Pour identifier les sites de glycosylation et reconstituer les étapes de la synthèse des oligosaccharides de type complexe, il fallait disposer d’un système expérimental simple. Sondra Schlesinger (Department of Microbiology and Immunology, Washington University School of Medicine, St. Louis), spécialiste de la génétique des bactéries et de la réplication des virus enveloppés à ARN, comme le virus Sindbis, suggéra à Stuart Kornfeld d’utiliser le Virus de la Stomatite Vésiculaire (VSV) ; il appartient à la famille des Rhabdoviridae et provoque chez certains mammifères une forme d’influenza. Son génome à ARN code cinq protéines majeures parmi lesquelles la glycoprotéine G de l’enveloppe virale (VSV-G). Le virus peut être cultivé sur cellules ovariennes de hamster chinois et sur cellules de mammifères infectées par le virus, ou transfectées avec le gène codant pour VSV-G ; la synthèse des protéines cellulaires est détournée au profit de la production de protéines virales.
Références : Leavitt R, Schlesinger S, Kornfeld S Tunicamycin Inhibits Glycosylation and Multiplication of Sindbis and vesicular stomatitis viruses (1977)
Gibson R, Leavitt R, Kornfeld S, Schlesinger S Synthesis and infectivity of vesicular stomatitis virus containing nonglycosylated G protein (1978)
VSV-G porte une chaîne oligosaccharidique de type N-glycane. Il existe un mutant VSV-G, sensible à la température ; lorsque les cellules sont cultivées à une température restrictive (40°C), la protéine synthétisée est mal conformée et ne franchit pas le « contrôle de qualité » du reticulum endoplasmique. Si l’on revient à la température permissive (32°C), la protéine mal repliée adopte sa conformation normale, franchit le contrôle de qualité et passe du reticulum endoplasmique au complexe de Golgi. Le passage de la température permissive à la température restrictive bloque une étape de la voie sécrétoire ; on peut alors déterminer la composition en sucres de la chaîne glycanique à cette étape. Des anticorps spécifiques anti VSV-G sont employés pour l’immuno-localisation de la glycoprotéine au microscope. Le degré de résolution peut être augmenté en utilisant un gène hybride qui permet de coupler la VSV-G à la protéine fluorescente verte (Green Fluorescent Protein, GFP). En 1962, Osamu Shimomura (Boston University School of Medicine) a découvert dans les cellules de la méduse Aequorea victoria une protéine émettant une fluorescence verte après excitation lumineuse dans l’ultraviolet. Martin Chalfie (Columbia University) comprit tout l’intérêt que présente cette protéine verte fluorescente comme marqueur en biologie. Roger Yonchien Tsien (University of California, San Diego) élargit la gamme des longueurs d’onde d’excitation et d’émission utilisables en construisant des protéines modifiées plus fluorescentes et émettant une lumière jaune, bleue ou violette, permettant d’aborder simultanément l’étude de plusieurs processus intracellulaires. Shimomura, Chalfie et Tsien reçurent le prix Nobel de chimie en 2008.
Références : Shimomura O Extraction, purification and properties of Aequorin, a bioluminescent protein from luminous hydromedusan, Aequora (1962)
Chalfie M, Tu Y, Euskirchen G, Ward WW, Prasher DC Green fluorescent protein as a marker for gene expression (1994)
Maiti A, Buffalo CZ, Saumya S, Montecinos-Franjola F, Hachey JS, Conlon WJ, Tran GN, Hassan B, Walters KJ, Drobizhev M, Moerner WE, Ghosh P, Matsuo H, Tsien RY, Lin JY, Rodriguez EA Structural and photophysical characterization of the small ultra-red fluorescent protein (2023)
La fusion du gène codant pour la glycoprotéine VSV-G (normale ou mutée) avec celui codant pour GFP produit un gène hybride que l’on peut introduire par transfection dans le génome d’une cellule ; il devient alors possible de visualiser en microscopie à fluorescence le déplacement de la protéine G du reticulum endoplasmique à la membrane plasmique en passant par le Golgi. Le volume de la protéine hybride aurait pu perturber son cheminement le long de la voie sécrétoire ; à l’heureuse surprise des expérimentateurs, il n’en a rien été. L’usage des protéines hybrides VSV-G – GFP a été largement utilisé dans l’étude de la voie sécrétoire. Les sites intracellulaires de glycosylation de la VSV-G ont été identifiés par Lawrence A. Summers, James R. Etchison et Donald F. Summers (Department of Microbiology, University of Utah College of Medicine, Salt Lake City) dans les cellules HeLa et BHK21, infectées par le virus et marquées (pulse chase) avec des sucres tritiés (3H). Après fractionnement par centrifugation, ils ont caractérisé le site d’incorporation de la glucosamine et du mannose dans la fraction enrichie en reticulum endoplasmique rugueux ; les sucres périphériques – galactose, acide sialique, fucose, et peut-être une autre glucosamine – sont incorporés dans la fraction membranaire de faible densité (enrichie en vésicules et tubules lisses dérivant du reticulum endoplasmique et du complexe de Golgi). Ils ont également mis en évidence qu’avant addition de l’acide sialique en position terminale de la chaîne glycanique, l’oligosaccharide polymannosylé et glucosylé subit un élagage. VSV-G est une glycoprotéine membranaires. Seymour J. Singer (University of California, San Diego), l’inventeur avec Garth L. Nicolson (Salk Institute for Biological Studies, La Jolla) du modèle de la « mosaïque fluide », a suivi son parcoursdans les cellules ovariennes de hamster chinois infectées par le VSV. Pour synchroniser le cheminement des VSV-G nouvellement synthétisées, John E. Bergman a utilisé un mutant sensible à la température. La séquence des étapes, du reticulum endoplasmique à la membrane plasmique, a été suivie par immunofluorescence et immunomicroscopie électronique sur coupes ultra fines. Utilisant un système de synthèse protéique in vitro – extrait de germe de blé en présence de microsomes de pancréas – Harvey F. Lodish et coll. ont démontré que l’insertion de VSV-G dans la membrane du reticulum endoplasmique s’effectue pendant la synthèse du polypeptide ; l’extrémité carboxy-terminale (la plus courte) émerge sur la face cytosolique de la membrane ; l’extrémité amino-terminale (l’essentiel de la protéines) est située dans le lumen, où s’effectue l’addition de la chaîne glycanique.
Références : Hunt LA, Summers DF Glycosylation of vesicular stomatitis virus glycoprotein in virus-infected HeLa cells (1976)
Hunt LA, Etchison JR, Summers DF Oligosaccharide chains are trimmed during synthesis of the envelope glycoprotein of vesicular stomatitis virus (1977)
Katz FN, Rothman JE, Lingappa VR, Blobel G, Lodish HF Membrane assembly in vitro: synthesis, glycosylation, and asymmetric insertion of a transmembrane protein (1977)
Katz FN, Rothman JE, Knipe DM, Lodish HF Membrane assembly: synthesis and intracellular processing of the vesicular stomatitis virus glycoprotein (1977)
Zilberstein A, Snider MD, Porter M, Lodish HF Mutants of vesicular stomatitis virus blocked at different stages in maturation of the viral glycoprotein (1980)
Bergmann JE, Tokuyasu KT, Singer SJ Passage of an integral membrane protein, the vesicular stomatitis virus glycoprotein, through the Golgi apparatus en route to the plasma membrane (1981)
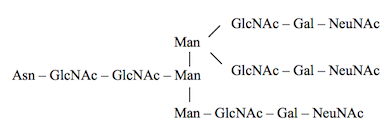
Les trois types d’oligosaccharides assemblés dans le reticulum endoplasmique et le Golgi sont : (i) les oligosaccharides de type complexe : GlcNAc2-Man3-GlcNAc2-Gal2 ; (ii) les oligosaccharides riche en mannose : GlcNAc2-Man7 ; (iii) les oligosaccharides de type hybride : GlcNAc2-Man7-GlcNAc2-Gal2.
La biosynthèse des oligosaccharides de type complexe, commence sur la face cytosolique de la membrane du reticulum endoplasmique et se poursuit sur la face luminale. Les réactions sont catalysées par des mannosyl- et glucosyl-transférases, dont le site catalytique est orienté vers le lumen ; les donneurs de mannose et de glucose sont des nucléotides-sucres : GDP-mannose, UDP-glucose, synthétisés dans le cytosol et transportés dans le lumen par les transporteurs de nucléotides-sucres ; l’accepteur luminal est le Dol-P-P-GlcNAc2-Man5 et le produit de la réaction est le Dol-PP-tétradéca-saccharide :
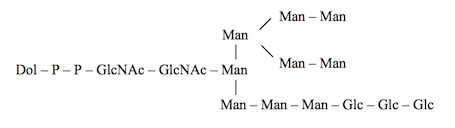 |
| Chaîne oligomannosidique liée au dolichol pyrophosphate. Ce type de chaîne est présent dans le reticulum endoplasmique. |
Le second enzyme-clé de la voie biosynthétique des glycoprotéines, l’oligosaccharyl-tranférase, catalyse la réaction :
avec formation d’une liaison N-ß D-glycosyle entre le tétradéca-saccharide et l’asparagine du tripeptide Asn-aa-Ser/Thr, où aa est un acide aminé protéinogène à l’exclusion de la proline. L’oligosaccharyl-transférase est un hétéro oligomère composé de huit sous-unités parmi lesquelles les ribophorines I et II découvertes par Gert Kreibich et David Sabatini (Department of Cell Biology, New York University School of Medicine). Le transfert co-traductionnel de l’oligosaccharide se fait à proximité du site où le polypeptide émerge du ribosome si bien que le translocon (dont il sera question plus loin) et l’oligosaccharyl transférase ne forment qu’une seule superstructure moléculaire du domaine ribosomal du reticulum endoplasmique (Alain Amar-Costesec et Henri Beaufay, 1981). Immédiatement après le transfert co-traductionnel du tétradéca-saccharide sur la chaîne peptidique naissante, le glucose terminal est retiré par la glucosidase I. Kunwar Shailubhai, Budhan S Pukazhenthi et coll. (Department of Animal Sciences, University of Maryland) ont montré que le site actif de cet enzyme transmembranaire est localisé dans le lumen. L’oligosaccharide lié au polypeptide :
est reconnu par la malectine, caractérisée par Thomas Schallus et coll (European Molecular Biology Laboratory, Heidelberg) ; cette protéine membranaire du reticulum endoplasmique participe au recrutement de la glucosidase II, un hétérodimère qui hydrolyse la liaison α-1,3 de deux molécules de glucose pour donner naissance à l’oligosaccharide lié au polypeptide :
reconnu par les chaperonnes calnexine et calréticuline, qui aident la glycoprotéine néoformée à adopter ses structures secondaire et tertiaire.
Références : Kreibich G, Ulrich BL, Sabatini DD Protein of rough microsomal membranes related to ribosome binding. I. Identification of ribophorins I and II, membrane proteins characteristic of rough microsomes (1978)
Amar-Costesec A, Beaufay H A structural basis of enzymic heterogeneity within liver endoplasmic reticulum (1981)
Shailubhai K, Pukazhenthi BS, Saxena ES, Varma GM, Vijay IK Glucosidase I, a transmembrane endoplasmic reticular glycoprotein with a luminal catalytic domain (1991)
Schallus T, Jaeckh C, Fehér K, Palma AS, Liu Y, Simpson JC, Mackeen M, Stier G, Gibson TJ, Feizi T, Muhle-Goll C Malectin: A Novel Carbohydrate-binding Protein of the Endoplasmic Reticulum and a Candidate Player in the Early Steps of Protein N-Glycosylation (2008)
Strous GJ, Van Kerkhof P, Brok R, Roth J Brada D Glucosidase II, a protein of the endoplasmic reticulum with high mannose oligosaccharide chains and a rapid turnover (1987)
Pelletier MF, Marcil A, Sevigny G, Jakob CA, Tessier DC, Chevet E, Menard R, Bergeron JJ, Thomas DY The heterodimeric structure of glucosidase II is required for its activity, solubility, and localization in vivo (2000)
Ware FE, Vassilakos A, Peterson PA, Jackson MR, Lehrman MA, Williams DB The molecular chaperone calnexin binds Glc1Man9GlcNAc2 oligosaccharide as an initial step in recognizing unfolded glycoproteins (1995)
La phase d’élagage de l’oligosaccharide a d’abord intrigué les biochimistes ; la nécessité de ce processus de démolition partielle d’un glycane qui vient juste d’être assemblé n’apparut pas de prime abord jusqu’à la découverte du « cycle de contrôle de qualité ». Il convient de souligner l’importance de ce contrôle qui se déroule dans le reticulum endoplasmique et concerne tous les polypeptides néo-synthétisés par les ribosomes liés à la membrane : l’apparition à la surface des cellules d’une glycoprotéine membranaire de conformation anormale peut provoquer le déclenchement d’une réaction immunitaire dévastatrice.
Références : Williams DB Beyond lectins: the calnexin/calreticulin chaperone system of the endoplasmic reticulum (2006)
Ellgaard L, McCaul N, Chatsisvili A, Braakman I Co- and Post-Translational Protein Folding in the ER (2016)
Pour que les glycoprotéines solubles ou membranaires acquièrent leur structure tertiaire, elles sont, dès leur translocation dans le lumen du reticulum endoplasmique, prises en charge par des chaperonnes. La « voie générale » met en œuvre la chaperonne BIP et la protéine disulfure isomérase. La Binding Immunoglobulin Protein, très abondante dans le réticuloplasme, est l’homologue de la protéine de choc thermique de 70 kDa (Heat Shock Protein 70) ; comme toutes les protéines de cette famille, elle est produite en grande quantité lorsque la cellule est soumise à une élévation de température ; BIP maintient les polypeptides naissants dans un état propice à leur repliement correct. Un élément important de l’acquisition de la structure tertiaire est l’établissement de ponts disulfure entre les atomes de S des fonctions thiol de deux cystéines. Cette modification post-traductionnelle est catalysée par la protéine disulfure isomérase ; la PDIA 3 (Endoplasmic Reticulum Protein 57 ou 59) et ERp72, isolées par Richard A. Mazzarella et coll. (Department of Microbiology, St. Louis University School of Medicine), sont des résidents permanents du reticulum endoplasmique ; elles possèdent à leur extrémité carboxy-terminale les signaux de rétention KDEL et KEEL, respectivement (voir plus loin).
Référence : Mazzarella RA, Srinivasan M, Haugejorden SM, Green M ERp72, an abundant luminal endoplasmic reticulum protein, contains three copies of the active site sequences of protein disulfide isomerase (1990)
Contrôle de qualité
Les protéines ayant acquis leur structure tridimensionnelle correcte sont transférées vers le Golgi ; celles qui sont incorrectement repliées ou assemblées sont re-glucosylées par l’UDP-glucose: glycoprotéine glucosyl transférase ; elles subissent alors un tour supplémentaire du cycle calnexine-calréticuline. Richard K Plemper et coll., dans le groupe de Dieter H Wolf (Institut für Biochemie, Universität Stuttgart) ont montré que les glycoprotéines recalées, après plusieurs cycles de contrôle de qualité, sont partiellement déglycosylées, expulsées du réticuloplasme à travers le rétro-translocon (Sec 61), et dégradées par le système cytosolique ubiquitine protéasome.
Références : Bordallo J, Plemper RK, Finger A, Wolf DH Der3p/Hrd1p is Required for Endoplasmic Reticulum-associated Degradation of Misfolded Lumenal and Integral Membrane Proteins (1998)
Plemper RK, Bordallo J, Deak PM, Taxis C, Hitt R, Wolf DH Genetic interactions of Hrd3p and Der3p/Hrd1p with Sec61p suggest a retro-translocation complex mediating protein transport for ER degradation (1999)
Les glycoprotéines solubles ayant acquis leur structure tridimensionnelle correcte sont triées dans le reticulum endoplasmique ; (i) celles qui portent à leur extrémité carboxy-terminale un signal de rétention sous forme du tétrapeptide Lys-Asp-Glu-Leu (KDEL) deviennent des résidentes permanentes du reticulum : calréticuline (Calcium Binding Protein 3), Glucose Regulated Protein 94 (CaBP4), calnexine, protéine disulfure isomérase, protéine de 78k (Glucose Regulated Protein 78), protéine de choc thermique 90k, CaBP1 (membre de la famille de la thiorédoxine), Endoplasmic Reticulum Chaperone Protein GRP94 (CaBP4) présente dans le reticulum endoplasmique lisse… Pour les glycoprotéines membranaires, le signal de rétention serait localisé dans un domaine hydrophobe amino-terminal ou dans le domaine transmembranaire. Les glycoprotéines dépourvues de signal de rétention sont transportées par une noria de vésicules et accèdent aux compartiments suivants : complexe de Golgi, membrane plasmique, ou sont exportées à l’extérieur de la cellule.
Références : Pääbo S, Bhat BM, Wold WS, Peterson PA A short sequence in the COOH-terminus makes an adenovirus membrane glycoprotein a resident of the endoplasmic reticulum (1987)
Munro S, Pelham HR A C-terminal signal prevents secretion of luminal ER proteins (1987)
Peter F, Nguyen Van P, Söling HD Different sorting of Lys-Asp-Glu-Leu proteins in rat liver (1992)
Poruchynsky MS, Tyndall C, Both GW, Sato F, Bellamy AR, Atkinson PH Deletions into an NH2-terminal hydrophobic domain result in secretion of rotavirus VP7, a resident endoplasmic reticulum membrane glycoprotein (1985)
Machamer CE, Rose JK A specific transmembrane domain of a coronavirus E1 glycoprotein is required for its retention in the Golgi region (1987)
Le cycle calnexine/calréticuline de contrôle de qualité met en jeu deux protéines dont les « domaines lectine » présentent des similarités de séquence. Ayant fait l’objet d’études dans le groupe de Marek Michalak (Department of Biochemistry, University of Alberta), calnexine et calréticuline sont des chaperonnes fixant le Ca2+; elles ne reconnaissent que les glycoprotéines néo-synthétisées portant un glucose à l’extrémité de leur glycane lié à N :
Comme BIP, calréticuline et calnexine ont pour fonction d’assister le processus de « repliement » des polypeptides et l’acquisition des structures secondaires (hélice α, feuillet plissé β) et tertiaires. La calréticuline est présente dans l’espace luminal. La calnexine appartient à une famille de chaperonnes moléculaires ; elle a été détectée en 1982 dans le reticulum endoplasmique de différents tissus et cellules sous forme d’une protéine de masse moléculaire apparente 90 kDa. C’est une protéine transmembranaire exprimée dans les portions lisse et rugueuse du reticulum endoplasmique. Sa séquence primaire est hautement conservée, particulièrement le domaine N-terminal intraluminal responsable de la fonction chaperonne. Pour accomplir leur fonction, calréticuline et calnexine fixent un « facteur de repliement », une thiol oxydoréductase baptisée ERp57 (Endoplasmic Reticulum Protein 57). Une peptidyl prolyl isomérase (cyclophiline B) facilite le remodelage de l’activité de certains polypeptides en facilitant la transition de la forme cis à la forme trans. La glycoprotéine correctement repliée est libérée des complexes avec la calnexine ou la calréticuline après élimination du Glc interne restant par la glucosidase II.
Références : Gelebart P, Opas M, Michalak M Calreticulin, a Ca2+-binding chaperone of the endoplasmic reticulum (2005)
Coe H, Michalak M Calcium binding chaperones of the endoplasmic reticulum (2009)
Wada I, Rindress D, Cameron PH, Ou WJ, Doherty JJ 2nd, Louvard D, Bell AW, Dignard D, Thomas DY, Bergeron JJ SSR alpha and associated calnexin are major calcium binding proteins of the endoplasmic reticulum membrane (1991)
Ou WJ, Thomas DY, Bell AW, Bergeron JJ Casein kinase II phosphorylation of signal sequence receptor alpha and the associated membrane chaperone calnexin (1992)
Hochstenbach F, David V, Watkins S, Brenner MB Endoplasmic reticulum resident protein of 90 kilodaltons associates with the T- and B-cell antigen receptors and major histocompatibility complex antigens during their assembly (1992)
Glycoprotéines
Chez les eucaryotes, un tiers environ des protéines sont des glycoprotéines. Elles sont omniprésentes dans les tissus animaux et végétaux, et chez les micro-organismes. Chez les mammifères, tous les tissus et les liquides biologiques – plasma sanguin, lait, larmes, salive, urine – renferment des glycoprotéines dont les oligosaccharides sont en majorité liés à N. Elles abondent dans la matrice extracellulaire, la membrane plasmique et les organites subcellulaires. Pour ne prendre que l’exemple du noyau, elles sont présentes dans l’enveloppe et les pores nucléaires, la chromatine, le nucléole, le nucléoplasme… De même pour les mitochondries, les lysosomes, les peroxysomes, le réticulum endoplasmique, le complexe de Golgi et le cytosquelette. Le cytosol contient peu de glycoprotéines et leur glycane ne comporte qu’une molécule de N-acétylglucosamine (GlcNAc) liée à un résidu sérine ou thréonine.
Références : Bennet G, Hemming R, Lavoie PA Presence of glycoproteins in the cell nucleus as shown by autoradiographic studies after administration of (3H) fucose and (3H) galactose (1986)
Hart GW, Holt GD, Haltiwanger RS Nuclear and cytoplasmic glycosylation: novel saccharide linkages in unexpected places (1988)
Davis LI, Blobel G Nuclear pore complex contains a family of glycoproteins that includes p62: glycosylation through a previously unidentified pathway (1987)
La découverte par Santiago Ramon y Cajal (Université de Madrid) du lien entre Golgi et sécrétion fut largement confirmée par les travaux du groupe de George Palade, au Rockefeller Institute, sur la voie sécrétoire dans les cellules des acini pancréatiques. Des travaux ultérieurs ont établi le lien entre Golgi et glycosylation des protéines. Les scientifiques engagés dans ces recherches ont sélectionné des cellules sécrétrices comme modèle expérimental. Les cellules caliciformes (goblet cells), l’un des quatre types de cellules de la muqueuse intestinale, répondent particulièrement bien à ce critère dans la mesure où elles fabriquent et exportent des glycoprotéines à longues chaînes d’hydrate de carbones : les « mucines », découvertes en 1914 par Ramon y Cajal. Elles forment une couche protectrice (cell coat) à la surface de la paroi intestinale et sont responsables du pouvoir lubrifiant du mucus. D’une manière plus générale, les cellules des muqueuses et des épithéliums sont protégées et lubrifiées par les mucoprotéines (muco-polysaccharides) qu’elles synthétisent et sécrètent.
A la différence des cellules animale ou végétale, la cellule bactérienne est directement soumise aux variations de pression osmotique générées par le milieu environnant ; aussi sont-elles entourées d’un filet de protection de peptidoglycanes. Chez les eubactéries, les peptidoglycanes forment une structure macromoléculaire continue, pseudo cristalline, qui double la bicouche phospholipidique de la membrane plasmique. Les peptidoglycanes (muréines) sont formés par l’association de N-acétyl-glucosamine et d’acide N-acétyl-muramique en longues séquences linéaires et répétitives. Ils sont interconnectés par de courts peptides de trois à cinq résidus d’acides aminés.
Complexe de Golgi : structure et fonction
« Chaque fois que nous entendrons dire : de deux choses l’une, empressons-nous de penser que, de deux choses, c’est vraisemblablement une troisième. »
Jean Rostand
Le complexe de Golgi est le compartiment central de la voie sécrétoire. Il est traversé par un intense trafic de vésicules transportant des protéines, des lipides et des phospholipides de leur lieu de synthèse – le reticulum endoplasmique –- vers le compartiment où ils exercent leur fonction : membrane plasmique (récepteurs hormonaux, transporteurs, canaux ioniques), endosomes, lysosomes (pompe à protons, transporteurs, hydrolases), compartiment extracellulaire (où aboutissent la majorité des protéines synthétisées dans le reticulum). La sécrétion est un phénomène vital chez les êtres vivants, des bactéries à l’homme ; la plupart des cellules de mammifères synthétisent en permanence et libèrent dans le milieu extracellulaire des peptides et des protéines nécessaires à la croissance (hormones), à la digestion (zymogènes), à la transmission de l’influx nerveux (neurotransmetteurs et autres messagers chimiques établissant la communication de cellule à cellule), à la régulation de la glycémie (insuline) et à la défense immunitaire (antigènes). La voie sécrétoire a aussi pour fonction d’ajuster en permanence la composition de la membrane plasmique par addition et retrait de lipides et de récepteurs protéiques membranaires.
C’est au sein du Golgi que se font la glycosylation des protéines et des lipides mais, alors que les étapes initiales dans le reticulum endoplasmique, la synthèse et le transfert du précurseur oligo mannosidique, sont très conservées chez les eucaryotes, les étapes ultérieures dans le Golgi diffèrent selon les espèces : synthèse de glycanes polymannosylés chez les levures, de N-glycanes complexes chez les mammifères, les plantes, les invertébrés et les insectes. Ces modifications post-traductionnelles mettent en œuvre plus de cent glycosyl-transférases différentes. Le nombre élevé d’enzymes s’explique en partie par le fait qu’ils sont spécifiques d’une forme stéréo-isomérique des sucres, notamment des formes anomériques α ou β (par référence à la position du groupe OH par rapport au plan de la molécule) : il y a, par exemple, une GlcNAc β-1,4 galactosyl-transférase, une Gal α-1,3 galactosyl-transférase, une GlcNAc α-1,3 fucosyl-tranférase, une Gal α-1,2 fucosyl-tranférase. L’acide sialique en périphérie de la chaîne oligosaccharidique est lié à un galactose par une liaison α−2,6 entre le C2 en conformation α de l’acide sialique et le C6 du galactose. L’élagage des sucres de la chaîne oligosaccharidique mobilise des mannosidases, des glucosidases et d’autres glycosydases. Le Golgi est également impliqué dans la sulfatation et la phosphorylation des protéines ; il renferme une sulfotransférase et une sulfatase . La première catalyse l’estérification par un groupe sulfate de la fonction phénol des résidus tyrosine du fibrinogène, et la fonction alcool d’un sucre dans les polyholosides comme les glycosaminoglycanes de la matrice extracellulaire. Le donneur de groupes sulfate est le phospho-adénosine phosphosulfate (PAPS). Le Golgi contient des phosphatases et des enzymes qui catalysent la synthèse, dans les cellules végétales, d’une variété de polysaccharides et des pectines ; il contient aussi des enzymes qui catalysent l’acylation des protéines virales.
A la fin des années 1960, il était établi (i) que l’édification de la chaîne oligosaccharidique des glycoprotéines implique deux organites différents : le reticulum endoplasmique et le complexe de Golgi et (ii) que l’addition et la soustraction de sucres se fait de manière séquentielle. La notion d’une distribution non uniforme des enzymes dans le complexe de Golgi s’est alors imposée. Plusieurs approches expérimentales ont été mises en œuvre pour localiser les enzymes – glycosyl-transférases et glycosidases – entre le cis-Golgi, les citernes cis, médianes et trans du dichtyosome et le trans-Golgi : le fractionnement subcellulaire par centrifugation en gradient de densité a fourni peu d’informations, à l’exception du travail de William G. Dunphy et James E. Rothman montrant des différences de distribution des glycosyl-transférases dans les fractions.
Références : Bergeron JJ, Ehrenreich JH, Siekevitz P, Palade GE Golgi fractions prepared from rat liver homogenates. II. Biochemical characterization (1973)
Merrit WD, Morré DJ A glycosyltransferase of high specific activity in secretory vesicles from isolated Golgi apparatus of rat liver (1973)
Dunphy WG, Fries E, Urbani LJ, Rothman JE Early and late functions associated with the Golgi apparatus reside in distinct compartments (1981)
Ravoet AM, Amar-Costesec A, Beaufay H Topology of Mannosyltransferase, Glucosyltransferase and N-acetylglucosamine Phosphotransferase in rat liver (1982)
Dunphy WG, Rothman JE Compartmentation of asparagine-linked oligosaccharide processing in the Golgi apparatus (1983)
Les résultats de la cytochimie ou de l’immunomicroscopie électronique avec des anticorps marqués ont révélé des différences de localisation des phosphatases.
Références : Clermont Y, Lalli M, Rambourg A Ultrastructural localization of nicotinamide adenine dinucleotide phosphatase (NADPase), thiamine pyrophosphatase (TPPase), and cytidine monophosphatase (CMPase) in the Golgi apparatus of early spermatids of the rat (1981)
Roth J, Berger EG Immunocytochemical localization of galactosyltransferase in HeLa cells: codistribution with thiamine pyrophosphatase in trans-Golgi cisternae (1982)
Sinowatz F, Amselgruber W Cytochemical localization of nicotinamide adenine dinucleotide phosphatase (NADPase) in bovine Leydig cells (1986)
Velasco A, Hidalgo J Cytochemical localization of thiamine pyrophosphatase and nicotinamide adenine dinucleotide phosphatase activities in rat epiphyseal chondrocytes (1987)
Dunphy WG, Brands R, Rothman JE Attachment of terminal N-acetylglucosamine to asparagine-linked oligosaccharides occurs in central cisternae of the golgi stack (1985)
Enfin, des résultats significatifs ont été obtenus sur la localisation des glycosyl-transférases par marquage avec des anticorps fluorescents et microscopieconfocale à balayage laser. La dissection biochimique, génétique et microscopique de la fonction des 23 gènes SEC de Saccharomyces cerevisiae (Peter Novick et Randy Scheckman, Department of Molecular and Cell Biology, University of California, Berkeley) a apporté des informations essentielles sur la machinerie moléculaire de la voie sécrétoire.
Références : Berger EG, Thurnher M, Müller U Galactosyltransferase and sialyltransferase are located in different subcellular compartments in HeLa cells (1987)
Berger EG, Grimm K, Bächi T, Bosshart H, Kleene R, Watzele M Double immunofluorescent staining of alpha 2,6 sialyltransferase and beta 1,4 galactosyltransferase in monensine-treated cells: evidence of different Golgi compartments? (1987)
Le tableau suivant est un résumé des résultats obtenus :
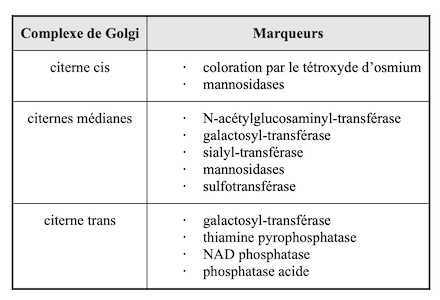 |
Le tableau ci-dessous montre la séquence, de haut en bas, des réactions catalysées par les glycosyl-transférases :
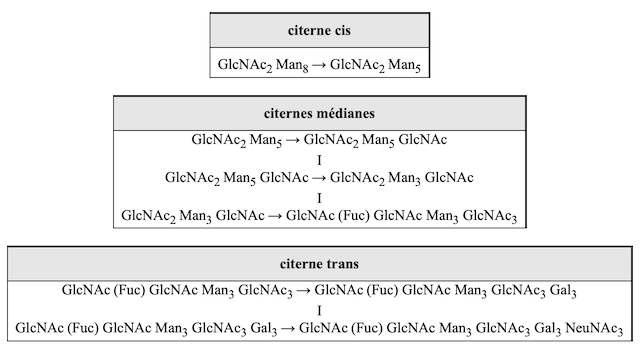 |
Note: La première étape de la biosynthèse des chaînes glycaniques dans le reticulum endoplasmique : le transfert de GlcNAc-1-P de l’UDP-GlcNAc sur le dolichol phosphate, par la GlcNAc-phosphotransférase, est inhibée par la tunicamycine, un antibiotique nucléosidique. Les glycosidases effectuent des coupures dans la chaîne oligosaccharidique en fonction de sa composition en sucres, qui varie d’un compartiments à l’autre du Golgi. Le transfert de fucose sur la N-acétylglucosamine liée à l’asparagine de la chaîne polypeptidique est catalysée par la GlcNAc α-1,3 fucosyl-tranférase.
Les images tridimensionnelles obtenues par tomographie microscopique montrent la complexité et le polymorphisme du Golgi : sa forme varie d’un type cellulaire à l’autre : des citernes de forme ovale agencées en panier (cellules épithéliales du canal de l’épididyme), un réseau de rubans allongés (cellules des acini pancréatiques), une cage sphérique (cellules sécrétoires de l’hypophyse antérieure). Dans les cellules animales et végétales, le nombre de saccules par dichtyosome et le nombre de dichtyosomes par cellule sont variables. Aussi spectaculaires soient-elles, les reconstitutions tridimensionnelles ne rendent pas compte du caractère dynamique du Golgi. Seules des études sur cellules vivantes permettent d’aborder cette question. L’emploi de cargos marqués avec la protéine verte fluorescente ont permis l’observation au microscope des mouvements des tubules et vésicules d’un compartiment cellulaire à l’autre. Des améliorations techniques ont marqué le passage à une morphologie quantitative : la mesure de la fluorescence émises par les chimères de protéines solubles ou membranaires avec la protéine verte fluorescente donne une évaluation du nombre de molécules transportées et permet d’établir les paramètres cinétiques du transport dans la voie sécrétoire. Un double marquage avec des protéines vertes fluorescentes avec des spectres d’excitation/émission différents ouvre la possibilité de comparer le sort de deux cargo protéiques.
Pour rendre compte des données expérimentales sur le fonctionnement de la voie sécrétoire, deux modèles ont été proposés. (i) Le Golgi est un organite dynamique. La première citerne (cis-Golgi, ERGIC ER-Golgi intermediate compartment) se forme par agrégation et fusion de vésicules issues de domaines spécialisés du reticulum endoplasmique et enfermant le cargo protéique. Cette citerne et son cargo entreprennent une migration antérograde. Sa composition en protéines résidentes se modifie au fur et à mesure de sa progression vers le trans-Golgi. Un flux rétrograde de vésicules rétablit la spécificité de chaque compartiment en renvoyant des protéines vers le compartiment en amont et en ajoutant de nouvelles, fournies par le compartiment en aval. La citerne trans achève sa maturation en devenant le trans-Golgi, qui donne naissance aux vésicules sécrétoires. Le modèle de maturation des citernes (Cisternal maturation model) est essentiellement basé sur des données de microscopie tridimensionnelle sur cellules vivantes, avec prises d’images en accéléré (three-dimensional time-lapse microscopy). L’hypothèse de la maturation membranaire (flow differentiation) avait été formulée dans les années 1960 par Hilton Mollenhauer, W Gordon Whaley et James D. Morré (The Plant Research Institute, The University of Texas, Austin).
Références : Mollenhauer HH, Whaley WG An observation on the functioning of the Golgi apparatus (1963)
Mironov AA, Mironov Jr AA, Beznoussenko GV, Trucco A, Lupetti P, Smith JD, Geerts WJC, Koster AJ, Burger KNJ, Martone ME, Deerinck TJ, Ellisman MH, Luini A ER-to-Golgi carriers arise through direct en bloc protrusion and multistage maturation of specialized ER exit domains (2003)
Morré DJ, Mollenhauer HH Microscopic morphology and the origins of the membrane maturation model of Golgi apparatus function (2007)
Le modèle morphologique du transport vésiculaire (Stable compartment model) fut proposé dans les années 1980. Le Golgi est un organite statique, stabilisé par ses liaisons avec le cytosquelette. Au cours du transport du cargo, l’équipement enzymatique spécifique des citernes est conservé. Le déplacement antérograde du cargo, d’une citerne à la suivante, est assuré par des navettes de vésicules jusqu’au trans-golgi ; les protéines membranaires golgiennes impliquées dans le trafic sont ramenées à leur saccule d’origine par des vésicules se déplaçant dans le sens rétrograde. Aucun des deux modèles n’est en mesure de rendre compte de la totalité des faits. Chaque modèle est en accord avec un certain nombre d’observations et en contradiction avec d’autres : par exemple, le fait que des cargos de différentes tailles ou natures ne se déplacent pas à la même vitesse dans le Golgi. Les deux modèles ne s’excluent pas totalement l’un l’autre ; on pourrait imaginer une coexistence des deux mécanismes avec un transport antérograde par migration de citernes et un transport rétrograde par vésicules.
Dans une variante du modèle de progression et maturation des citernes un rôle est attribué aux connections tubulaires entre citernes – visibles dans les structures tridimensionnelles. Ces connexions joueraient un rôle dans le trafic bidirectionnel. Un modèle récent fait intervenir des protéines monomériques G (Rab), liées aux membranes par un groupe prényl. Les Rab sont des GTPases appartenant à la super famille des proto-oncogènes Ras. Ces molécules régulatrices et ubiquitaires interviennent (avec d’autres facteurs) dans tous les trafics intracellulaires entre compartiments membranaires : sélection du cargo, formation des vésicules à partir du compartiment donneur, fusion avec la membrane du compartiment receveur. La voie biosynthétique de certaines protéines évite le passage obligé par la voie sécrétoire classique ; elles transitent directement du réticulum endoplasmique vers la membrane plasmique en court-circuitant le complexe de Golgi et en l’absence de vésicules COP fonctionnelles : HSP 150, une protéine de choc thermique O-glycosylée de la levure Saccharomyces cerevisiae, invertase, Voltage-gated K+ channel et la protéine régulatrice Kv Channel Interacting Protein de l’extrémité dendritique des neurones.
Références : Suntio T, Shmelev A, Lund M, Makarow M The sorting determinant guiding Hsp 150 to the COPI-independent transport pathway in yeast (1999)
Foeger NC, Marionneau C, Nerbonne JM Co-assembly of Kv4 {alpha} subunits with K+ channel-interacting protein 2 stabilizes protein expression and promotes surface retention of channel complexes (2010)
Trafic vésiculaire
Les vésicules sont les éléments fonctionnels de l’intense trafic, évoqué au début du paragraphe précédent, et qui se déroule entre le reticulum endoplasmique et la membrane plasmique. Le trafic vésiculaire est essentiel pour maintenir la structure et la fonction des organites, et donc l’existence de la cellule ; il soulève au moins trois questions : (i) comment se forment les vésicules et la sélection du cargo à partir de l’organite donneur ? (ii) comment les vésicules issues d’un compartiment donneur trouvent-elles l’organite accepteur ? (iii) comment s’opère la fusion de la vésicule avec la membrane de l’organite accepteur ?
Le transport met en jeu des vésicules tapissées de cotamères, COPI et COPII et des vésicules tapissées de clathrine. Les vésicules COP (Coat Protein) ont été découvertes parmi les protéines codées par les gènes SEC de la levure Saccharomyces cerevisiae. Les vésicules COPII assurent le transport antérograde du reticulum endoplasmique rugueux vers le cis-Golgi et du cis-Golgi vers le trans-Golgi. La fonction des vésicules COPI (Coat Protein complex I) a longtemps été débattue ; on leur a d’abord attribué un rôle dans le transport antérograde du cargo. Leur rôle dans le transport rétrograde du cis-Golgi vers le reticulum endoplasmique a été découvert en 1996 par Randy W. Schekman (University of California, Berkeley), et par Lelio Orci et coll. (Département de morphologie, Université de Genève). Le transport rétrograde remplit deux fonctions : (i) maintenir l’équipement enzymatique et les capacités biosynthétiques du compartiment donneur ; les données expérimentales montrent que ce c’est le cas alors qu’il émerge continuellement du compartiment donneur des vésicules destinées au compartiment accepteur (ii) renvoyer vers le reticulum endoplasmique les protéines mal formées ayant échappé à la sanction du contrôle de qualité. Ces protéines doivent être éliminées car elles représentent un risque potentiel pour la survie de la cellule qu’il existe un double contrôle de qualité, dans le reticulum endoplasmique et dans le complexe de Golgi. Je traiterai plus loin de la fonction des vésicules à clathrine.
Références : Oka T, Nakano A Inhibition of GTP hydrolysis by Sar1p causes accumulation of vesicles that are a functional intermediate of the ER-to-Golgi transport in yeast (1994)
Yamanushi T, Hirata A, Oka T, Nakano A Characterization of yeast sar1 temperature-sensitive mutants, which are defective in protein transport from the endoplasmic reticulum (1996)
Saito Y, Kimura K, Oka T, Nakano A Activities of mutant Sar1 proteins in guanine nucleotide binding, GTP hydrolysis, and cell-free transport from the endoplasmic reticulum to the Golgi apparatus (1998)
La membrane des vésicules COP est une bicouche phospholipidique dans laquelle sont insérées trois types de protéines intégrales : (i) enzymes destinés au Golgi, protéines (récepteurs) destinées à la membrane plasmique, protéines (récepteurs) destinées aux endosomes/lysosomes ; (ii) récepteurs du cargo « soluble » (récepteurs KDEL, le motif d’adressage des protéines résidentes du reticulum endoplasmique) ; (iii) protéines de fusion membranaire (vSNARE). Les vésicules sont entourées d’une enveloppe formée d’un complexe protéique, le cotamère ; l’enveloppe des vésicules COPI est formée d’heptamères COP 1 (Coat Protein de type 1) ; l’enveloppe des vésicules COPII, d’heptamères COP 2 (Coat Protein de type 2).
Les vésicules COP prennent naissance à partir de la membrane des domaines lisse ou ribosomial du reticulum endoplasmique, au niveau de sites de sortie (exit sites). L’intéracation d’une vésicule avec une membrane, que ce soit sa membrane d’origine ou sa membrane cible, implique une désorganisation localisée de la bicouche phospholipidique. Sur la membrane du reticulum endoplasmique cette fonction est assurée par une hélice α amphipathique de petites GTPases ; en insérant sa face hydrophobe dans le feuillet cytoplasmique de la bicouche phospholipidique, elle induit une asymétrie entre les deux feuillets, et une courbure de la membrane. Sur la membrane cible (le cis-Golgi), elle met en jeu une hélice α de 20 à 40 résidus d’acides aminés, l’Amphipathic Lipid Packing Sensor. Le motif ALPS a été découvert en 2005, à l’extrémité N-terminale d’une protéine régulatrice de l’activité des GTPases (Arf GTPase-Activating Protein 1). Son affinité pour les membranes présentant une courbure a été étudiée, en particulier par Joëlle Bigay et coll. (Université Côte d’Azur). Le cargo fait l’objet d’une sélection, comme on a pu le démontrer avec un matériel suffisamment volumineux pour être visible en microscopie électronique, et suivi chronologiquement. La sélection s’opère par interactions protéine-protéine du type ligand-récepteur, entre des récepteurs de la membrane et des protéines du réticuloplasme. De plus, l’insertion des GTPases provoque une curvature de la membrane ; le bourgeonnement est accentué par la polymérisation du cotamère, comme on a pu le montrer par microscopie électronique pour le cotamère COPI ; ce dernier interagit spécifiquement avec des protéines et les concentre dans le bourgeon.
Références : Zeuschner D, Geerts WJ, van Donselaar E, Humbel BM, Slot JW, Koster AJ, Klumperman J Immuno-electron tomography of ER exit sites reveals the existence of free COPII-coated transport carriers (2006)
Bigay J, Casella JF, Drin G, Mesmin B, Antonny B ArfGAP1 responds to membrane curvature through the folding of a lipid packing sensor motif (2005)
Drin G, Casella JF, Gautier R, Boehmer T, Schwartz TU, Antonny B A general amphipathic alpha-helical motif for sensing membrane curvature (2007)
Vanni S, Vamparys L, Gautier R, Drin G, Etchebest C, Fuchs PF, Antonny B (2013) Amphipathic Lipid Packing Sensor Motifs: Probing Bilayer Defects with Hydrophobic Residues (2013)
Dans les années 1980, James Rothman (Department of Cellular Biochemistry and Biophysics Memorial Sloan-Kettering Cancer Center, New York) mit en évidence le transport vésiculaire en système acellulaire. Il prépara une fraction membranaire enrichie en éléments du Golgi à partir de cellules CHO (Chinese Hamster Ovary cell line), souvent utilisée pour les recherches en génétique (existence de mutants). Il suivit le sort de la glycoprotéine G-VSVentre un compartiment donneur : des citernes golgiennes d’une lignée cellulaire déficiente en N-acétylglucosaminyl-transférase, et un compartiment receveur : les citernes golgiennes de la lignée sauvage. Le passage de la glycoprotéine G-VSV d’un compartiment à l’autre se traduisait par l’incorporation de 3H-N-acétylglucosamine.
Références : Balch WE, Dunphy WG, Braell WA, Rothman JE Reconstitution of the transport of protein between successive compartments of the Golgi measured by the coupled incorporation of N-acetylglucosamine (1984)
Balch WE, Rothman JE Characterization of protein transport between successive compartments of the Golgi apparatus: Asymmetric properties of donor and acceptor activities in a cell-free system (1985)
Rothman JE, Orci L Movement of proteins through the Golgi stack: a molecular dissection of vesicular transport (1990)
En 1988, Vivek Malhotra et coll montrèrent que le transport à travers le Golgi met en jeu un facteur sensible à la N-éthyl-maléimide. Pour rappel, la N-éthyl-maléimide est un oxydant et un inhibiteur des ATPases. Le N-ethylmaleimide sensitive factor (NSF) est une protéine cytosolique. Dans un milieu d’incubation contenant du Golgi, du cytosol et de l’ATP on observe, en l’absence de ce facteur, une accumulation de vésicules « nues », sans enveloppe. Le NSF s’associe à d’autres protéines cytosoliques : les Soluble NSF Attachment Proteins (α-SNAP, β-SNAP, γ-SNAP) que Douglas O. Clary et coll. ont purifiées à partir de cytosol de cerveau de bœuf. Les SNAP sont très conservées parmi les espèces ; on les retrouve dans le cytosol de levure. James E. Rothman interpréta la formation du complexe membranaire SNAP-NSF comme étant l’amorce d’une « machinerie de fusion » multimérique, nécessaire au transport vésiculaire. Les résultats des expériences ultérieures ont apporté la preuve que NSF et SNAPs sont les composants essentiels et universels de l’appareil de fusion membranaire, que la fusion soit « constitutive » ou régulée, comme dans le cas de la libération de neurotransmetteurs.
Références : Malhotra V, Orci L, Glick BS, Block MR, Rothman JE Role of an N-ethylmaleimide-sensitive transport component in promoting fusion of transport vesicles with cisternae of the Golgi stack (1988)
Wilson DW, Whiteheart SW, Widemann M, Brunner M Rothman JE A Multisubunit Particule Implicated in Membrane Fusion (1992)
L’enveloppe des vésicules COP est assemblée à partir de facteurs recrutés dans le cytosol et, en premier lieu, des GTPases. Il existe un thème général commun à la formation de tous les types de vésicules ; elle débute par l’activation d’une protéine à GTP : Sar1 (Secretion Associated Ras-superfamily gene 1) chez la levure ou ARF (ADP Ribosylation Factor) chez les mammifères. Ces deux facteurs appartiennent à la superfamille des protéines RAS (RAt Sarcoma), des guanosine triphosphatase de petites taille, activées par des facteurs d’échange de guanine (Guanine exchange factor, GTPase-activating proteins). Les protéines RAS ont été découvertes au début des années 1980 dans le génome humain par Edward M. Scolnick et coll., lors d’études sur les virus cancérigènes isolés dans les années 1960 par Jennifer Harvey et Werner Kirsten (Harvey et Kirsten murine sarcoma viruses). Les cinq principales familles – Rab, Ran, Ras, Rho, Arf – diffèrent les unes des autres par des différences de structure. Elles régulent le trafic dans tous les compartiments de la cellule. Certaines, comme Rab1 (Rat Brain 1) sont liées aux membranes par un groupement géranylgéranyle. Leur activité est soumise à une régulation positive par les Guanine nucleotide exchange factor et à une régulation négative par les GTPase-activating proteins ; elles passent de la forme inactive Sar1-GDP à la forme active Sar1-GTP ; de même pour ARF : ARF-GDP (forme inactive) – ARF-GTP (forme active). Prenons l’exemple de la protéine G Arf1 : elle est activée par l’Arf GAP1 (ADP Ribosylation Factor GTPase Activating Protein 1) son facteur d’échange (GBF1) localisé au cis-Golgi. Arf1, lié à la membrane de la vésicule en formation, recrute un complexe soluble constitué de sept sous-unités, le cotamère. La structure tridimensionnelle d’un complexe de recrutement (Sar1-GTP, Sec23/24) a été élucidée par cristallographie aux rayons X.
Références : Chang EH, Gonda MA, Ellis RW, Scolnick EM, Lowy DR Human genome contains four genes homologous to transforming genes of Harvey and Kirsten murine sarcoma viruses (1982)
Melançon P, Glick BS, Malhotra V, Weidman PJ, Serafin T, Orci L, Rothman JE A role for GTP-binding proteins in vesicular transport through the Golgi complex (1989)
Serafini, T, Orci L, Amherdt M, Brunner M, Kahn RA, Rothman JE ADP-Ribosylation Factor is a Subunit of the coat of Golgi-derived COP-coated vesicles: a novel role for a GTP-binding protein (1991)
Barlowe C, Orci L, Yeung T, Hosobuchi M, Hamamoto S, Salama N, Rexach MF, Ravazzola M, Amherdt M, Schekman R COPII: a membrane coat formed by Sec proteins that drive vesicle budding from the endoplasmic reticulum (1994)
Yamanushi T, Hirata A, Oka T, Nakano A Characterization of yeast sar1 temperature-sensitive mutants, which are defective in protein transport from the endoplasmic reticulum (1996)
Kuehn MJ, Herrmann JM, Schekman R COPII-cargo interactions direct protein sorting into ER-derived transport vesicles (1998)
Bi X, Corpina RA, Goldberg J Structure of the Sec23/24–Sar1 pre-budding complex of the COPII vesicle coat (2002)
Stenmark H Rab GTPases as coordinators of vesicle traffic (2009)
Les vésicules ayant sélectionné le cargo au niveau des sites de sortie (ERES, ER Exit Sites) de la membrane du reticulum endoplasmique accostent sur la membrane du cis-Golgi et les membranes de la vésicule et de la citerne-cible fusionnent. C’est à ce stade qu’interviennent les récepteurs membranaires du complexe NSF-SNAP : les SNAP receptors (SNARE, Soluble N-ethylmaleimide-sensitive-factor Attachment protein REceptor) ; ils ont été isolés à partir d’un extrait de cerveau. Les neurones sont un modèle pour l’étude des SNARE. Dans le cerveau, de nombreux processus mettent en jeu des fusions membranaires : la libération des neurotransmetteurs met en jeu la fusion les vésicules synaptiques avec la membrane plasmique. Plusieurs membres de la famille des SNARE ont été identifiés à partir de la membrane plasmique neuronale : la synaptobrévine (VAMP, Vesicle Associated Membrane Protein), la syntaxine et la protéine synaptosomale de 25 kDa (SNAP-25, SyNaptosomal Associated Protein of 25 kDa). La synaptobrévine est un moteur moléculaire vésiculaire (v-SNARE) ; la syntaxine et SNAP-25 sont des moteurs moléculaires de la membrane cibles ( target, t-SNARE). Les membres de la superfamille SNARE jouent un rôle clef dans la reconnaissance et la fusion des vésicules ; l’interaction v-SNARE – t-SNARE permet de vaincre la barrière énergétique empêchant la fusion spontanée des membranes. La séquence et la structure tridimensionnelle des SNARE des v-SNARE – riches en arginine – et des t-SNARE – riches en glutamine – sont conservées parmi les espèces.
L’existence de l’enveloppe des vésicules est transitoire. Dans les vésicules COPI, une GAP (GTPase Activating Protein), l’Arf GAP1 (Arf GTPase Activating Protein) désactive Arf1 en hydrolysant le GTP ; la dépolymérisation du manteau démasque les protéines impliquées dans la fusion. Il s’agit de molécules allongées, riches en hélices α. Lors de la fusion, les protéines SNARE se transforment en une configuration ternaire extrêmement stable, un enroulement en superhélice (coiled coil) généralement composé de v-SNARE, de la synaptobrévine (VAMP), de t-SNARE, de syntaxine et de SNAP-25. La formation de ce complexe conduit à la fusion des membranes, entraînant la libération du cargo de la vésicule. Les protéines solubles sont déversées dans l’espace luminal ou à l’extérieur de la cellule et les protéines membranaires sont insérées dans la membrane du compartiment accepteur. Le recyclage de la machinerie SNARE commence lorsque l’α-SNAP et le NSF se lient à la syntaxine et au SNAP-25. James Rothman et Randy Schekman ont partagé le prix Nobel de médecine ou physiologie 2013 pour leur contribution au déchiffrage du mécanisme du trafic vésiculaire et à l’identification des principaux acteurs. Le troisième co-titulaire du prix était Thomas Südhof (Stanford University, Palo Alto).
Références : Clary DO, Rothman JE Purification of three related peripheral membrane proteins needed for vesicular transport (1990)
Clary DO, Griff IC, Rothman JE SNAPs, a family of NSF attachment proteins involved in intracellular membrane fusion in animals and yeast (1990)
Söllner T, Whiteheart SW, Brunner M, Erdjument-Bromage H, Geromanos S, Tempst P, Rothman JE SNAP receptors implicated in vesicle targeting and fusion (1993)
Sutton RB, Fasshauer D, Jahn R, Brunger AT Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 angstrom resolution (1998)
Sutton RB, Fasshauer D, Jahn R, Brunger AT Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution (1998)
Weiss WI, Scheller RH Membrane fusion. SNARE the rod, coil the complex (1998)
Nickel W, Weber T, McNew JA, Parlati F, Sollner TH, Rothman JE Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs (1999)
McNew JA, Parlati F, Fukuda R, Johnston RJ, Paz K, Paumet F, Söllner TH, Rothman JE Compartmental specificity of cellular membrane fusion encoded in SNARE proteins (2000)
Littleton JT, Barnard RJO, Titus SA, Slind J, Chapman ER, Ganetzky B Snare complex disassembly by NSF follows synaptic vesicle fusion (2001)
Weber T, Zemelman BV, McNew JA, Westermann B, Gmachi M, Parlati F, Söllner TH, Othman JE SNAREpins: minimal machinery for membrane fusion (1998)
Antonin W, Fasshauer D, Becker S, Jahn R, Schneider TR Crystal structure of the endosomal SNARE complex reveals common structural principles of all SNAREs (2002)
Bigay J, Gounon P, Robineau S, Antonny B Lipid packing sensed by ArfGAP1 couples COPI coat disassembly to membrane bilayer curvature (2003)
Dans le schéma classique de la voie sécrétoire, le cis-Golgi est placé immédiatement en aval du reticulum endoplasmique. On distingue maintenant un compartiment intermédiaire (ERGIC, ER Golgi Intermediate Compartment) ; il a fait l’objet d’études par le groupe de Hans-Peter Hauri (Biozentrum, Universität Basel) sur cellules d’hépatome humain HepG2, par immuno-microscopie en fluorescence. Bien que l’on ait décrit l’existence d’interconnections tubulaires, il semble établi que la formation du compartiment ERGIC soit le résultat de la coalescence de vésicules (VTC, Vesicular Tubular Cluster) sous le contrôle des petites GTPases Rab et Arf et impliquant les SNAREs. Les vésicules COPII, provenant des sites de sortie du reticulum endoplasmique (ER-exit sites), assurent le transport antérograde du cargo vers le compartiment intermédiaire ; le compartiment ERGIC est aussi alimenté par le transport rétrograde de vésicules en provenance du Golgi. La lectine ERGIC-53 reconnait les groupes mannosyl des glycoprotéines et participe au contrôle de qualité.
Références : Hauri HP, Schweizer A The endoplasmic reticulum-Golgi intermediate compartment (1997)
Klumperman J, Schweizer A, Clausen H, Tang BL, Hong W, Oorschot V, Hauri HP The recycling pathway of protein ERGIC-53 and dynamics of the ER-Golgi intermediate compartment (1998)
Moussalli M, Pipe SW, Hauri HP, Nichols WC, Ginsburg D, Kaufman RJ Mannose-dependent endoplasmic reticulum (ER)-Golgi intermediate compartment-53-mediated ER to Golgi trafficking of coagulation factors V and VIII (1999)
Mironov AA, Mironov AA Jr, Beznoussenko GV, Trucco A, Lupetti P, Smith JD, Geerts WJ, Koster AJ, Burger KN, Martone ME, Deerinck TJ, Ellisman MH, Luini A ER-to-Golgi carriers arise through direct en bloc protrusion and multistage maturation of specialized ER exit domains (2003)
Ben-Tekaya H, Miura K, Pepperkok R, Hauri HP Live imaging of bidirectional traffic from the ERGIC (2005)
Lord C, Ferro-Novick S, Miller EA The Highly Conserved COPII Coat Complex Sorts Cargo from the Endoplasmic Reticulum and Targets It to the Golgi (2013)
Le Golgi est un organite complexe. L’approche morphologique « statique », en deux dimensions, a apporté son lot d’information sur son architecture : les données obtenues par l’examen de coupes ultra fines (70–100 nm) au microscope électronique à transmission sont à la base de nos connaissances : un empilement de saccules entouré de tubules, de vésicules et de structures membranaires polymorphes. Pour découvrir d’éventuelles connexions entre saccules ou entre dictyosomes, il fallait accéder à des représentations tridimensionnelles. La première approche expérimentale utilisée, l’examen au microscope électronique de coupes en séries a été supplanté par la tomographie électronique à haut voltage (High-voltage dual axis 3D electron tomography) sur coupes épaisses (3 à 4 µm).
Références : Rambourg A, Clermont Y, Marraud A Three-dimensional structure of the osmium-impregnated Golgi apparatus as seen in the high voltage electron microscope (1974)
Rambourg A, Clermont Y, Marraud A Three-dimensional structure of the osmium-impregnated Golgi apparatus as seen in the high voltage electron microscope (1974)
Rambourg A, Clermont Y, Hermo L Three-dimensional architecture of the golgi apparatus in Sertoli cells of the rat (1979)
Rambourg A, Segretain D, Clermont Y Tridimensional architecture of the Golgi apparatus in the atrial muscle cell of the rat (1984)
Dylewski DP, Haralick RM, Keenan TW Three-dimensional ultrastructure of the Golgi apparatus in bovine mammary epithelial cells during lactation (1984)
Rambourg A, Clermont Y Tridimensional structure of the Golgi apparatus in type A ganglion cells of the rat (1986)
Rambourg A, Clermont Y Three-dimensional electron microscopy: structure of the Golgi apparatus (1990)
Ladinsky MS, Mastronarde DN, McIntosh JR, Howell KE, Staehelin LA Golgi structure in three dimensions: functional insights from the normal rat kidney cell (1999)
La microscopie corrélative CLEM (Correlative Light and Electron Microscopy) permet de combiner les images obtenues, à partir d’un même échantillon, par microscopie à fluorescence sur des cellules vivantes et en temps réel, et par microscopie électronique. La préparation de l’échantillon à observer (fixation, enrobage, coupe) est faite à température cryogénique. La protéine verte fluorescente (GFP), ou une chimère protéine-GFP, peut être détectée et ciblée par microscopie confocale à balayage laser (Confocal Laser Scanning Microscopy) avant d’être observée au microscope électronique ; celle-ci fournit les données ultra-structurales qui font défaut avec la microscopie à fluorescence et cette dernière fournit des information sur le mécanisme et la dynamique d’un processus cellulaire, comme la voie sécrétoire, qui sont inaccessibles par microscopie électronique. La microscopie corrélative CLEM permet d’étudier un échantillon avec une résolution inférieure au nanomètre.
Référence : Noske AB, Costin AJ, Morgan GP, Marsh BJ Expedited approaches to whole cell electron tomography and organelle mark-up in situ in high-pressure frozen pancreatic islets (2008)
Avec les travaux de Robert Eric Betzig (Molecular and Cell Biology Department, The University of California, Berkeley), l’imagerie microscopique a franchi une étape supplémentaire. La Near Field Scanning Optical Microscopy (NSOM) permet d’atteindre une résolution proche de celle obtenue avec un microscope électronique à balayage (500Å), à partir d’une radiation visible utilisable en milieu aqueux, ce qui rend accessible l’observation de cellules in vivo ou le transport intracellulaire à l’échelle moléculaire. Je renvoie au mémoire présenté par Betzig en 1988, le lecteur désireux de savoir comment il a réussi à produire des images à très haute résolution (inférieure au nanomètre) en franchissant la limite de diffraction des techniques conventionnelles de microscopie optique. Betzig a reçu le Prix Nobel de Chimie 2014 pour ses travaux sur la microscopie à fluorescence à super-résolution et la nano-microscopie.
Références : Betzig E, Lewis A, Harootunian A, Isaacson M, Kratschmer E Near Field Scanning Optical Microscopy (NSOM): Development and Biophysical Applications (1986)
Betzig RE Non-destructive optical imaging of surfaces with 500 ångstrom resolution (1988)
Betzig E, Trautman JK Near-Field Optics : Microscopy, Spectroscopy, and Surface Modification Beyond the Diffraction Limit (1992)
Gao L, Shao L, Higgins CD, Wu X, Goldstein B, Betzig E Noninvasive Imaging beyond the Diffraction Limit of 3D Dynamics in Thickly Fluorescent Specimens (2012)
Pour suivre le déplacement d’un cargo, la première technique utilisée fut l’immuno-microscopie électronique à l’aide d’anticorps. Le fait que le Golgi soit traversé par un flux continu de protéines et de lipides nécessitait de recourir à une approche morphologique « dynamique » et donc d’observer le déplacement du cargo in vivo et en temps réel. C’est devenu possible avec l’utilisation de la microscopie à super-résolution, des protéines fluorescentes (Green Fluorescent Protein, GFP) et des protéines fluorescentes phototransformables. La fluorescence des molécules n’est pas permanente ; son intensité diminue avec le temps et devient indétectable. On peut altérer et même éteindre la fluorescence, par exemple en irradiant le fluorophore avec un laser. Le photoblanchiment est à la base d’une technique dans laquelle on supprime la fluorescence d’une zone à laquelle on s’intéresse sans affecter la fluorescence des autres régions de l’organite ou de la cellule. C’est ainsi que l’on peut observer la dynamique d’un processus en temps réel à l’échelle nanométrique. Il en va de même avec les fluorophores photoactivables : on peut illuminer enfluorescence une zone particulière à un moment précis. Eric Betzig, Harald Hess et Jennifer Lippincott-Schwartz ont baptisé « localisation microscopique par photoactivation (PhotoActivated Localization Microscopy, PALM) la technique microscopique sur coupes fines qui leur a permis d’obtenir des images de protéines intracellulaires à une résolution spatiale de l’ordre du nanomètre. Les protéines fluorescentes photoactivables ont été successivement illuminées puis blanchies. Une fois rassemblées, les différentes images obtenues fournissent une image à super-résolution.
Références : Betzig E, Patterson GH, Sougrat R, Lindwasser OW, Olenych S, Bonifacino JS, Davidson MW, Lippincott-Schwartz J, Hess HF Imaging Intracellular Fluorescent Proteins at Nanometer Resolution (2006)
Takeuchi M, Ozawa T Methods for imaging and analyses of intracellular organelles using fluorescent and luminescent proteins (2007)
Lippincott-Schwartz J, Manley S Putting super-resolution fluorescence microscopy to work (2009)
Note: Yang Zhang et coll. (Department of Textile Engineering, Chemistry and Science, North Carolina State University, Raleigh) ont créé des fluorophores photoactivatables pouvant passer de l’état “émetteur de fluorescence” à l’ l’état “non émetteur” fluorophores.
Références : Yang Zhang Y, Zheng Y, Tomassini A, Singh AK, Raymo FM Photoactivatable Fluorophores for Bioimaging Applications (2023)
Jennifer Lippincott-Schwartz et coll. (Section on Organelle Biology, Cell Biology and Metabolism Branch, NIH, Bethesda) ont suivi le déplacement d’une chimère de la glycoprotéine-G membranaire avec la protéine verte fluorescente (VSVG-GFP). Après avoir quitté le reticulum endoplasmique, les vésicules s’assemblent en structures pré-golgiennes (VTC) de morphologies variables ; le déplacement des vésicules du Golgi vers la membrane plasmique est guidé par les microtubules. Une étude similaire a été effectuée par Nelson B. Cole et coll. avec des glycosyl transférases.
Références : Cole NB, Smith CL, Sciaky N, Terasaki M, Edidin M, Lippincott-Schwartz J Diffusional Mobility of Golgi Proteins in Membranes of Living Cells (1996)
Presley JF, Cole NB Schroer TA, Hirschberg K, Zaal KJ, Lippincott-Schwartz J ER-to-Golgi transport visualized in living cells (1997)
Hirschberg K, Miller CM, Ellenberg J, Presley JF, Siggia ED, Phair RD, Lippincott-Schwartz J Kinetic analysis of secretory protein traffic and characterization of golgi to plasma membrane transport intermediates in living cells (1998)
Exocytose, endocytose
Pour rester dans le cadre de ce chapitre, je définirai l’exocytose comme le mécanisme d’exportation des protéines sécrétoires entre le réseau trans-golgien et la membrane plasmique. Plus généralement, c’est le mécanisme par lequel la cellule exporte dans le milieu extracellulaire des molécules (hormones, neurotransmetteurs) ou des complexes moléculaires volumineux. Le transport s’effectue par vésicules, issues du trans-Golgi et qui fusionnent avec la membrane plasmique. Il existe une exocytose constitutive, présente chez toutes les cellules eucaryotes ; il existe aussi une exocytose régulée par les ions Ca2+, par exemple chez les cellules du système nerveux.
La richesse en vésicules du cytoplasme des cellules eucaryotes a été révélée par l’examen de coupes fines au microscope électronique à transmission. Diverses tentatives ont été effectuées pour les isoler par fractionnement subcellulaire. Les cellules des tissus nerveux et placentaires sont particulièrement riches en vésicules. Les cellules du système nerveux central synthétisent des neuromédiateurs, les stockent dans des vésicules qui se déplacent le long des axones jusqu’au bouton synaptique et fusionnent avec la membrane de la synapse, libérant ainsi les neuromédiateurs dans l’espace interneuronal. Le placenta est composé de différents types de cellules parmi lesquelles les trophoblastes, qui sont le site d’échanges métaboliques entre le sang maternel et le fœtus. Les premières tentatives de fractionnement subcellulaire entreprises pour isoler les vésicules n’ont pas été couronnées de succès, en partie à cause de la présence de saccharose dans les milieux d’homogénéisation et de fractionnement ; cette molécule polaire altère les vésicules.
Barbara Pearse (Medical Research Council Laboratory of Molecular Biology, Cambridge) a utilisé un milieu isotonique sans saccharose pour isoler, par centrifugation en gradient de densité, les vésicules de cerveau de porc ; par la suite, elle utilisa un gradient de Ficoll, un copolymère de saccharose et d’épichlorhydrine, dissous dans l’eau lourde 2H2O. L’analyse, par électrophorèse en gel de polyacrylamide en présence de SDS, de la composition en protéines des vésicules isolées révéla la présence de polypeptides de poids moléculaires apparents de 36 à 180 kDa. Les vésicules « tapissées » isolées à partir d’une variété de tissus sont toutes constituées d’une membrane phospholipidique, entourée d’une couche de « complexes adaptateurs protéiques » (340 kDa, 4 sous-unités polypeptidiques). Cette couche est entourée d’une « cage » de clathrine. La présence de ces deux couches, et la manière dont elles imbriquées l’une dans l’autre, sont visibles dans la représentation tri-dimensionnelle obtenue par Thomas Walz et coll. (Department of Cell Biology, Harvard Medical School, Boston) par cryo-microscopie électronique à l’échelle sub-nanométrique,. La variété de poids moléculaires des polypeptides séparés par électrophorèse s’explique par le fait que les modes d’extraction utilisés libéraient des peptides issus des deux couches. Il est possible d’extraire le squelette de clathrine – « triskelion » – en traitant les vésicules par du cholate. La clathrine est constituée de trois chaînes lourdes (de 180 kDa) et de trois chaînes légères (36 à 40 kDa). Sa fonction serait essentiellement structurale. La taille des vésicules à clathrine est en moyenne de 80 nm. Dans les ovocytes de poulet coexistent des vésicules de 80 à 150 nm renfermant un contenu protéique, et des vésicules de 50 à 80 nm qui semblent vides. Il pourrait exister une navette incluant des grosses vésicules transportant le cargo du trans-Golgi vers la membrane plasmique et l’extérieur de la cellules, et de petites vésicules vides retournant vers le trans-Golgi.
Références : Pearse BMF Coated vesicles from pig brain: Purification and biochemical characterization (1975)
Pearse BMF On the structural and functional components of coated vesicles (1978)
Woods JW, Woodward MP, Roth TF Common features of coated vesicles from dissimilar tissues: composition and structure (1978)
Pearse BMF Coated vesicles from human placenta carry ferritin, transferrin, and immunoglobulin G (1982)
Fotin A, Cheng Y, Sliz P, Grigorieff N, Harrison SC, Kirchhausen T, Walz T Molecular model for a complete lattice from electron cryomicroscopy (2004)
Certaines molécules hydrophobes (hormones stéroïdes) peuvent franchir la bicouche phospholipidique de la membrane plasmique ; il en va de même pour les molécules de petite taille, non-chargées (urée, glycérol, eau). Pour les molécules polaires, comme les sucres (groupes hydroxyle), et les atomes et molécules chargés (Ca2+, Na+, K+, HCO3–, Cl–), le franchissement de la membrane plasmique se fait via des canaux ou des transporteurs. Les complexes volumineux ont recours à l’endocytose, le mécanisme par lequel les cellules de mammifères ou les êtres unicellulaires intériorisent les molécules nutritives et les hormones nécessaires à leur développement. La phagocytose est la capture par les cellules de particules solides dans le milieu environnant. Le terme « phagocytose » désignait à l’origine le processus de destruction des bactéries par les phagocytes (une catégorie de leucocytes), découvert en 1882 par Ilya Ilitch (Elie) Metchnikov (prix Nobel de médecine ou physiologie 1908). La pinocytose est le processus non spécifique d’internalisation de micromolécules et de liquide extracellulaire dans des vésicules de petite taille, dont le contenu est déversé dans les lysosomes.
Référence : Metchnikov E Leçons sur la pathologie comparée de l’inflammation (1891)
Dans pratiquement toutes les cellules eucaryotes, l’endocytose débute par une invagination localisée de la membrane plasmique, qui devient un puit tapissé (coated pit), puis une vésicule tapissée à clathrine. Ces vésicules se détachent de la membrane plasmique et fusionnent entre elles dans le cytosol pour former des endosomes précoces dont le contenu est voisin de la neutralité (pH 7,4). Il s’acidifie progressivement par le jeu de pompes à protons transportées par vésicules depuis le complexe de Golgi et insérées dans la membrane endosomale. Les protéines et les petites molécules internalisées par endocytose sont triées dans les endosomes et dirigées vers diverses destinations, dont les lysosomes.
Références : Lawrence M, Ray S, Babyonyshev M, Galluser R, Borhani DW, Harrison SC, Crystal Structure of the Ectodomain of Human Transferrin Receptor (1999)
Steere AN, Byrne SL, Chasteen ND, Mason AB Kinetic of iron release from transferrin bound to the transferrin receptor at endosomal pH (2012)
Cheng Y, Zak O, Aisen P, Harrison SC, Walz T Structure of the human transferrin receptor-transferrin complex (2004)
Prenons deux exemples d’internalisation par endocytose ; le cholestérol joue de multiples rôles dans les cellules : il entre dans la composition des membranes phospholipidiques, comme la membrane plasmique ; il entre dans la voie biosynthétique des œstrogènes, de la testostérone, des acides biliaires, de la vitamine D. Le cholestérol provient en partie de l’alimentation et en partie de la biosynthèse hépatique. Pour être distribué aux cellules, ce stérol circule dans le sang associé à des complexes lipoprotéiques. Les lipoprotéines de basse densité sont de volumineux ensembles formés d’une partie protéique, l’apolipoprotéine, de phospholipides, de triglycérides, de vitamines et de cholestérol. En 1974, Michael Brown et Joseph Goldstein (University of Texas Southwestern Medical Center, Dallas) découvrirent que l’entrée des LDL (Low Density Lipoproteins) dans les fibroblastes nécessite la présence d’un composant de la membrane plasmique. Cette observation conduisit à la découverte du récepteur membranaire des LDL et du rôle joué par les LDL dans la biosynthèse du cholestérol : elles véhiculent le cholestérol dans le plasma sanguin et pénètrent dans les hépatocytes, en se fixant sur le récepteur des LDL, et libèrent le cholestérol dans la cellule. Goldstein et Brown reçurent le prix Nobel de physiologie ou médecine en 1985.
Référence : Brown MS, Goldstein JL Familial hypercholesterolemia: Defective binding of lipoproteins to cultured fibroblasts associated with impaired regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity (1974)
Le cation fer (Fe3+/Fe2+), lié à quatre atomes d’azote d’une porphyrine, est le groupe prosthétique de l’hémoglobine ; ce pigment respiratoire, présent dans le sang des vertébrés, transporte l’oxygène des poumons vers les cellules. Le fer, absorbé par le tube digestif est transporté de l’intestin vers les cellules lié à une β-globuline de 77 kDa ; en effet, le fer ferrique (Fe3+) est insoluble dans le plasma sanguin et le fer ferreux (Fe2+) est toxique. La transferrine remplit à la fois un rôle de stockage et de transport ; elle est captée, par des récepteurs (Transferrin Receptor TfR1, TfR2) de la membrane plasmique. La transferrine, avec les deux atomes de fer Fe3+ qu’elle transporte, et son récepteur sont internalisés par endocytose dans des vésicules à clathrine. La structure cristallographique du récepteur et de son ligand a été établie du fait de leur implication en pathologie. Le complexe est intériorisé par endocytose dans des vésicules à clathrine formées par invagination de la membrane plasmique. Après passage dans les endosomes, l’acidification progressive du pH (pH initial 6,5) libère le fer (Fe3+) de l’apo-transferrine ; le récepteur est renvoyé à la membrane plasmique.
Références : C. Martin Lawrence, Ray S, Babyonyshev M, Galluser R, Borhani DW, Harrison SC Crystal Structure of the Ectodomain of Human Transferrin Receptor (1999)
Cheng Y, Zak O, Aisen P, Harrison SC, Walz T Structure of the human transferrin receptor-transferrin complex (2004)
Le trans-Golgi est un centre de tri des protéines
Le cis-Golgi est la porte d’entrée de la voie sécrétoire ; le réseau trans-golgien (Trans-Golgi Network, TGN) en est la porte de sortie. C’est le point d’aboutissement des vésicules COPII qui ont traversé le complexe de Golgi. On connaît sa structure microscopique : un groupe de chercheurs autour de Lucas A. Staehelin (University of Colorado, Boulder) a réalisé, par cryo-tomographie électronique à haut voltage,une reconstruction tri-dimensionnelle du trans-Golgi de cellule de rein de rat à une résolution de ∼7-nm.
Références : Clermont Y, Rambourg A, Hermo L Trans-Golgi network (TGN) of different cell types: three-dimensional structural characteristics and variability (1995)
Ladinsky MS, Mastronarde DN, McIntosh JR, Howell KE, Staehelin LA Golgi structure in three dimensions: functional insights from the normal rat kidney cell (1999)
On a identifié un certain nombre de protéines caractéristiques : (i) TGN51 (Trans-Golgi Network protein of 51 kDa), dans le placenta humain ; (ii) TGN38/41 (Trans-Golgi Network protein of 38/41 kDa), dont les deux isoformes (TGN38 et TGN41) ont été caractérisées chez le rat et la souris par Paul Luzio et coll. (European Molecular Biology Laboratory, Heidelberg). Les protéines TGN possèdent dans leur séquence des motifs qui dirigent leur localisation dans le trans-Golgi (Ser23-Tyr25-Leu28) ou leur recyclage entre la membrane plasmique et le trans-Golgi (motif à tyrosine Tyr-Gln-Arg-Leu). La glycoprotéine transmembranaire TGN38/4 intervient dans la formation des vésicules d’exocytose. Nous verrons plus loin que le trans-Golgi renferme aussi les récepteurs du mannose-6-phosphate. La fonction principale du trans-Golgi est d’effectuer le tri du cargo dans des vésicules de transport, qui sont spécifiques de trois destinations : (i) granules de sécrétion (destination par défaut des protéines sécrétoires : sérum albumine, collagène…) ; (ii) membrane plasmique (glycoprotéines transmembranaires, récepteurs) ; (iii) endosome ou lysosomes. Il existe aussi, à partir du réseau trans-golgien, un transport rétrograde par des vésicules COPI de glycosyl-transférases vers la citerne trans du dichtyosome. Les citernes cis, médiane et trans du Golgi produisent par bourgeonnement des vésicules COPI et COPII ; seule une citerne du réseau trans-golgien produit des vésicules à clathrine.
Références : Luzio JP, Brake B, Banting G, Howell KE, Braghetta P, Stanley KK Identification, sequencing and expression of an integral membrane protein of the trans-Golgi network (TGN38) (1990)
Reaves B, Horn M, Banting G TGN38/41 recycles between the cell surface and the TGN: brefeldin A affects its rate of return to the TGN (1993)
Wong SH, Hong W The SXYQRL sequence in the cytoplasmic domain of TGN38 plays a major role in trans-Golgi network localization (1993)
Reaves B, Horn M, Banting G TGN38/41 recycles between the cell surface and the TGN: brefeldin A affects its rate of return to the TGN (1993)
Ponnambalam S, Rabouille C, Luzio JP, Nilsson T, Warren G The TGN38 glycoprotein contains two non-overlapping signals that mediate localization to the trans-Golgi network (1994)
Kain R, Angata K, Kerjaschki D, Fukuda M Molecular cloning and expression of a novel human trans-Golgi network glycoprotein, TGN51, that contains multiple tyrosine-containing motifs (1998)
Les travaux du groupe de James Rothman ont abouti à la conclusion qu’au sein des cellules le transport par vésicules est organisé selon un schéma général, avec des variations en fonction les compartiments ; en ce qui concerne le trans-Golgi, les vésicules qui en sont issues transportent un cargo différent selon leur destination. Deux questions se posent : (i) Comment se fait la sélection du cargo en fonction des destinations ? (ii) Quel est le mécanisme qui permet à une vésicule de reconnaître sa membrane cible et de fusionner avec elle ? Le tri du cargo est opéré par des complexes hétéro-tétramériques de protéines adaptatrices (AP1, AP2, AP3) situées dans l’enveloppe des vésicules. Les résultats des études menées sur les cellules actives dans l’exocytose régulée de neurotransmetteurs (neurones) ou d’hormones (cellules endocrines) ont apporté une réponse à la seconde question. Jean-Pierre Henry (Université Diderot, Paris) a énuméré les méthodes physiques utilisées au cours de ces études, en particulier la microscopie en fluorescence excitée par onde évanescente qui permet d’observer à l’échelle nanométrique des phénomènes se produisant à la surface des membranes. En ce qui concerne la fusion entre la membrane de la vésicule et la membrane cible, j’ai mentionné dans le sous-chapitre « Trafic vésiculaire », le rôle des récepteurs de la superfamille des SNARE (Soluble N-ethylmaleimide-sensitive factor Attachment protein REceptor) – une soixantaine de membres chez les mammifères : v-Snare dans la membrane des vésicules, t-SNARE dans la membrane cible. L’interaction entre v-SNARE et t-SNARE commence dès que les deux membranes entrent en contact (docking et tethering).
Références : Rothman JE, Wieland FT Protein sorting by transport vesicles (1996)
Henry JP, Darchen F, Cribier S Physical techniques for the study of exocytosis in isolated cells (1998)
En 1883, le physiologiste Rudolf Heidenhain décrivit la présence de volumineux granules au sein des cellules pancréatiques. Hershey Warshawsky et coll. (Department of Anatomy, McGill University, Montreal) et George Palade et James Jamieson (Rockefeller Institute for Medical Research) ont montré que lorsqu’on injecte à un animal des acides aminés radioactifs, la radioactivité se retrouve in fine dans les grains de sécrétion qui occupent l’espace situé entre le trans-Golgi et la membrane plasmique ; ils stockent le cargo avant son exportation à l’extérieur de la cellule. Dans le pancréas exocrine, les enzymes digestifs (zymogènes) sont triés, empaquetés et compactés dans les granules de sécrétion qui se forment par évagination de la membrane du trans-Golgi, subissent un processus de maturation, se détachent du réseau trans-golgien et fusionnent avec la membrane plasmique. Le cargo est exporté dans des canaux conduisant à l’intestin. On distingue une « sécrétion constitutive » et une « sécrétion régulée » ; la première est présente chez toutes les cellules eucaryotes, par exemple, la sécrétion dans l’espace lacunaire d’hydrolases acides par les ostéoclastes, des cellules spécialisées dans la résorption du tissu osseux ; la seconde est présente dans les glandes digestives et les glandes exocrines, où l’exocytose est déclenchée par un stimulus ou des signaux hormonaux ; dans les cellules β du pancréas, une élévation du taux sanguin de glucose stimule le déclenchement de l’exocytose de l’insuline contenue dans les vésicules. Les glycoprotéines dont la destination finale est la membrane plasmique, voyagent dans la membrane des vésicules transportant le cargo soluble. Kai Simons et coll. ont mis en évidence l’implication du cytosquelette dans l’exocytose entre le trans-Golgi et la membrane plasmique en suivant, en microscopie confocale et vidéo-microscopie, le parcours de la protéine de fusion VSVG-GFP.
Références : Warshawsky H, Leblond CP, Droz B Synthesis and migration of proteins in the cells of the exocrine pancreas as revealed by specific activity determination from radioautographs (1963)
Jamieson JD, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. I. Role of the peripheral elements of the Golgi complex (1967)
Jamieson JG, Palade GE Intracellular transport of secretory proteins in the pancreatic exocrine cell. II. Transport to Condensing Vacuoles and Zymogen Granules (1967)
Salamero J, Sztul ES, Howell KE Exocytic transport vesicles generated in vitro from the trans-Golgi network carry secretory and plasma membrane proteins (1990)
Keller P, Toomre D, White J, Simons K. Dual color visualization of trans-Golgi network to plasma membrane trafficking using GFP-fusion proteins (1998)
Toomre D, Keller P, White J, Olivo J -C, Simons K. Dual-color visualization of trans-Golgi network to plasma membrane traffic along microtubules in living cells (1999)
Comme toutes les protéines synthétisées par les polysomes liés à la membrane du reticulum endoplasmique, les glycoprotéines lysosomiales sont dotées d’une « séquence topogénique » sous forme d’un peptide signal amino-terminal. Les travaux d’Elizabeth F. Neufeld (National Institute of Arthritis, Metabolism, and Digestive Diseases) sur la mucolipidose de type II ont conduit à l’identificationd’une seconde séquence topogénique sous forme d’un sucre phosphorylé, dirigeant ces glycoprotéines vers les lysosomes. La mucolipidose de type II (I-cell disease), ou maladie des cellules d’inclusion, est une maladie héréditaire à transmission autosomale récessive ; elle est causée par des mutations dans le gène codant pour les sous-unités α et β de la N-acétylglucosamine-phosphotransférase, un enzyme du cis Golgi. William S. Sly (St. Louis University School of Medicine) montra qu’une « forme acide » de la β-glucuronidase, une hydrolases lysosomale, est pinocytée plus activement par les fibroblastes dans le milieu de culture qu’une forme moins acide. La forme acide contenait un phosphate à proximité d’un résidu mannose. Après les observations de Neufeld , le résultat de Sly ouvrit la voie à l’élucidation de la voie métabolique du mannose 6-P, principalement, par les groupes de Stuart Kornfeld (Washington University School of Medicine, St. Louis) et de Kurt von Figura (Georg August Universität, Göttingen). Ira Tabas et Stuart Kornfeld isolèrent, partir de cellules marquées au 3H, un enzyme portant un Man-6-P ; ce résidu était insensible à un traitement par une phosphatase : le sucre phosphorylé était masqué par une N-acétylglucosamine. La synthèse de la séquence topogénique des glycoprotéines lysosomiales – un résidu Man-6-P en position terminale de la chaîne oligosaccharidique – est un processus en deux étapes : (i) dans le cis-Golgi, une N-acétylglucosamine-phosphotransférase, après reconnaissance de certaines séquences de la partie peptique des glycoprotéines lysosomiales, transfert un GlcNAc-P à partir d’UDP-GlcNAc à un ou plusieurs résidus Man ; (ii) l’étape cruciale est catalysée par une phosphodiestérase (Mannose-6-Phosphate Uncovering Enzyme) du trans-Golgi, qui retire le groupe GlcNAc, démasquant ainsi le Man-6-P. Chez les patients atteints de mucolipidose de type II, l’absence de synthèse du signal de localisation, entraîne l’exportation dans le plasma sanguin des hydrolases acides destinées aux lysosomes. Étant donné l’implication en pathologie de la déficience en phosphodiestérase, la structure cristallographique du Mannose-6-Phosphate Uncovering Enzyme a été élucidée par Alexei Gorelik et coll. (Department of Biochemistry, McGill University, Montreal). Le trans-Golgi renferme deux récepteurs membranaires du Man-6-P (Cation dependent Mannose-6-Phosphate Receptor, et Cation independent Mannose-6-Phosphate Receptor). Les hydrolases acides et les enzymes de la membrane lysosomiale liés au récepteur sont délivrés à leur destination par des navettes de vésicules à clathrine, dont le revêtement est formé de l’association d’adaptines et de triskélions. Le transfert du trans-Golgi aux lysosomes est direct, ou indirect avec passage par les endosomes. Les récepteurs du Man-6-P sont recyclés et retournent au trans-Golgi.
Références : Kaplan A, Achord DT, Sly WS Phosphohexosyl components of a lysosomal enzyme are recognized by pinocytosis receptors on human fibroblasts (1977)
Tabas I, Kornfeld S Biosynthetic intermediates of β-glucuronidase contain high mannose oligosaccharides with blocked phosphate residues (1980)
Varki A, Kornfeld S Identification of rat liver α-N-acetylglucosaminyl phosphodiesterase capable of removing “blocking”: α-N-acetylglucosamine residues from phosphorylated high mannose oligosaccharides of lysosomal enzymes (1980)
Hasilik A, Neufeld EF Biosynthesis of lysosomal enzymes in fibroblasts. Phosphorylation of mannose residues (1980)
Hasilik A, Klein V, Waheed A, Strecker G, von Figura K Phosphorylated oligosaccharides in lysosomal enzymes: identification of α-N-acetylglucosamine(1) phospho(6) mannose diester groups (1980)
Varki A, Kornfeld S Purification and characterization of rat liver α-N-acetylglucosaminyl phosphodiesterase (1981)
Waheed A, Hasilik A, von Figura K Processing of the phosphorylated recognition marker in lysosomal enzymes: characterization and partial purification of a microsomal α-N-acetylglucosaminyl phosphodiesterase (1981)
Pohlmann R, Waheed A, Hasilik A, von Figura K Synthesis of phosphorylated recognition marker in lysosomal enzymes is located in the cis part of Golgi apparatus (1982)
Goldberg DE, Kornfeld S Evidence for extensive subcellular organization of asparagine-linked oligosaccharide processing and lysosomal enzyme phosphorylation (1983)
Varki A, Sherman W, Kornfeld S Demonstration of the enzymatic mechanisms of α-N-acetyl-d-glucosaminidase (formerly called α-N-acetylglucosaminylphosphodiesterase) and lysosomal α-N-acetylglucosaminidase (1983)
Lazzarino DA, Gabel CA Biosynthesis of the mannose 6-phosphate recognition marker in transport-impaired mouse lymphoma cells: demonstration of a two-step-phosphorylation (1987)
Rohrer J, Kornfeld R Lysosomal Hydrolase Mannose 6-Phosphate Uncovering Enzyme Resides in the trans-Golgi Network (2001)
Gorelik A, Illes K, Nagar B Crystal Structure of the Mannose-6-Phosphate Uncovering Enzyme (2020)