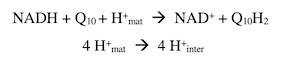Mitochondries
Sur la planète Terre, environ 90% de l’oxygène consommé par les êtres vivants est utilisé dans des organites subcellulaires appelés « mitochondries ». On en trouve les premières représentations dans un ouvrage publié en 1841 par Friedrich G. J. Henle, un élève de Johannes Peter Müller, titulaire de la chaire de physiologie et d’anatomie de la Friedrich-Wilhelm Universität, à Berlin. Les cellules musculaires ont d’importants besoins en énergie rapidement mobilisable ; les mitochondries sont les seuls organites capables de remplir cette fonction, ce qui explique pourquoi les tissus musculaires en contiennent de grandes quantités. Élève de Lorenz Oken, le pape de la Naturphilosophie, et de Johannes Peter Müller, Rudolph A. von Kölliker fut professeur de physiologie et d’anatomie comparée à l’Université de Wurtzbourg. Microscopiste expérimenté, il observa, en 1857, dans le sarcoplasme des muscles striés, des granules interstitiels individualisés qu’il appela körperchen (corpuscules) sui generis ». En 1890, Richard Altmann, professeur d’anatomie à l’Université de Leipzig, mit au point une technique de fixation et de coloration des tissus à l’aniline et fuschine ; il détecta la présence de « bioblastes » dans le cytoplasme des cellules. Walther Flemming, professeur d’anatomie à l’Université de Kiel, observa des « filae » dans une variété de tissus. L’utilisation d’un nouveau colorant, le cristal violet, permit à Carl Benda de détecter la présence de ces organites dans des tissus où ils sont peu abondants. Les microscopistes utilisèrent la coloration dite « vitale » au Vert Janus de Leonor Michaelis, plus connu pour avoir, avec Maud L. Menten, proposé en 1913 l’équation décrivant la cinétique des réactions enzymatiques. Au contact du colorant, les organites prennent une teinte bleu foncé ce qui révéla la présence de réactions d’oxydation. Les mitochondries furent d’abord appelées « granules de Kölliker », filae, bioblastes. En 1890, Retzius introduisit l’appellation « sarcosome » pour désigner les organites présents dans les muscles. En 1898, Carl Benda créa le terme « mitochondrie » par référence à la forme allongée de l’organite (mitos = fil). En 1909, Claudius Regaud (Faculté de médecine, Lyon) mit au point une technique de coloration des mitochondries et montra que « sarcosome » et « mitochondrie » désignent la même entité subcellulaire. Le terme « chondriosome », pour désigner les mitochondries, fut employé jusqu’au milieu du XXe siècle.
Références : Henle FGJ Allgemeine Anatomie: Lehre von den Mischungs-und Formbestandtheilen des Menschlichen Körpers (1841)
Altmann R Die Elementarorganismen und ihre Beziehungen zu den Zellen (1890)
Flemming W Zellsubstanz, Kern und Zellteilung (1882)
Benda C Ueber die Spermatogenese der Vertebraten und höherer Evertebraten, II Theil: Die Histiogenese der Spermien (1898)
Plusieurs hypothèses furent avancées concernant la nature et la fonction de ces organismes cytoplasmiques. Pour certains, il s’agissait de bactéries. Pour Richard Altmann, les « bioblastes » étaient des particules vivantes élémentaires dotées d’une autonomie métabolique et génétique, et capables de se reproduire ; c’était prémonitoire ! Le botaniste Andreas F.W. Schimper fit remarquer que les chloroplastes des cellules végétales présentent de nombreuses similarités avec les cyanobactéries. Les observations de Schimper ont inspiré le botaniste Konstantin S. Mereschkowski, professeur de microbiologie (Université fédérale de Kazan). En 1905, une vingtaine d’années après les travaux de Schimper, Mereschkowski inventa la « symbiogenèse » comme conclusion à ses travaux sur les lichens : des êtres primitifs (champignons, algues, lichens) peuvent s’associer pour former des êtres plus complexes. Il émit l’hypothèse que la capture de cyanobactéries par des protozoaires a conduit à l’apparition des chloroplastes des cellules végétales. Si l’article en allemand, qu’il publia en 1909, recueillit peu d’échos parmi les scientifiques, Ivan E. Wallin, professeur d’Anatomie (Medical School, University of Colorado) en eut connaissance. Il appliqua les déductions de Mereschkowski au cas des mitochondries. En 1922, et dans les années suivantes, il publia une série d’articles dans l’American Journal of Anatomy démontrant, sur des bases expérimentales, que les mitochondries proviennent de bactéries endocytées par la cellule primitive. Cette affirmation fut étayée lorsque l’examen au microscope électronique révéla la présence de ribosomes dans la matrice mitochondriale, donc d’un appareil de traduction. En 1980, la découverte de l’ADN mitochondrial (ADNmt) mit un point final à la controverse sur l’origine des mitochondries.
La théorie endosymbiotique est l’œuvre de la bactériologiste Lynn Margulis (Boston University). Cette théorie est une remise en cause radicale de la « théorie synthétique » chère aux néo-darwinistes du début du XXe siècle : les mutations génétiques et la sélection naturelle sont les seuls facteurs à l’origine de l’apparition de nouvelles espèces. Inutile de préciser que Margulis éprouva les plus grandes difficultés à publier le résultat de ses travaux ; bien que n’étant à l’époque qu’une enseignante en début de carrière, elle eut le mérite de tenir tête au désaveu de l’establishment universitaire et scientifique. Après une quinzaine de refus ! Son article fut accepté par le comité éditorial du Journal of Theoretical Biology ; il parut en 1966. Quinze plus tard, Margulis résuma le résultat de ses travaux dans un ouvrage qui parut en 1981 : les variations héréditaires, qui sont le moteur de l’évolution, ne proviennent pas seulement de mutations aléatoires ; il y a aussi une évolution par associations d’organismes primitifs (une α-protéobactérie aérobie avec une cellule primitive dans le cas des mitochondries). La cellule eucaryote est la composante d’une série d’associations symbiotiques avec des procaryotes capturés par la cellule primitive.
Les mitochondries se divisent en même temps que la cellule. Le génome mitochondrial est un génome compact, sans introns, dont l’ADN (comme celui des chloroplastes) présente de grandes similitudes avec l’ADN bactérien : il est souvent bicaténaire et circulaire. Les hépatocytes renferment environ 4.000 mitochondries contenant 2 à 4 molécules d’ADNmt, par mitochondrie. La séquence de l’ADNmt chez la souris, l’homme et le bœuf fut établie par le groupe du MRC Laboratory of Molecular Biology, Cambridge (16.569 paires de bases pour l’ADNmt humain). Des erreurs de séquence furent corrigées en 1999. Les 37 gènes de l’ADNmt codent principalement pour des ARN (22 ARNt 2 ARNr) et 13 protéines.
Références : Altmann R Die Elementarorganismen und ihre Beziehungen zu den Zellen (1890)
Schimper AFW Ueber die Entwickelung der Chlorophyllkörner und Farbkörper Ueber Chlorophyllkörner Stärkebildner und Farbkörper (1883)
Mereschkowski K Über Natur und Ursprung der Chromatophoren im Pflanzenreiche (1905)
Mereschkowski K Theorie der zwei Plasmaarten als Grundlage der Symbiogenesis, einer neuen Lehre von der Entstehung der Organismen (1910)
Wallin IE On the Nature of Mitochondria (1922)
Wallin IE Symbionticism and the Origin of Species (1927)
Margulis L The Origin of Mitosing Eukaryotic Cells (1966)
Margulis L Symbiosis in Cell Evolution (1981)
Margulis L Archaeal-eubacterial mergers in the origin of Eukarya: phylogenetic classification of life (1996)
Anderson S, Bankier AT, Barrell BG, de Bruijn MHL, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJH, Staden R, Young IG Sequence and organization of the human mitochondrial genome (1981)
Des « granules respiratoires »
En 1789, dans son laboratoire de l’Arsenal, à Paris, Antoine Laurent de Lavoisier et son disciple Armand Séguin montrèrent que l’oxygène est indispensable à la combustion et, chez les animaux, à la respiration. Chez ces derniers, la consommation d’oxygène s’accompagne d’une production de gaz carbonique. Malheureusement pour Lavoisier, il cumulait avec sa fonction de régisseur des poudres et salpêtres la charge de fermier général, c’est-à-dire de collecteur d’impôts ; il fut arrêté pendant la Terreur et traduit devant le tribunal révolutionnaire qui, décrétant que « la République n’a pas besoin de savants », envoya à la guillotine le plus grand chimiste de son temps.
A quoi sert l’oxygène inspiré par nos poumons ? Où va-t-il exactement ? En 1912, l’histologiste Benjamin F. Kingsbury émit l’hypothèse que l’oxygène fourni par la respiration est consommé dans les mitochondries. Ainsi naquit la notion de « respiration cellulaire », une appellation qui désigne l’ensemble des processus métaboliques qui permettent à un être vivant de tirer des nutriments qu’il ingurgite l’énergie nécessaire à ses besoins vitaux. La respiration cellulaire fut le grand sujet d’études des biochimistes du début du XXe siècle. En 1910, alors qu’il était étudiant dans le laboratoire d’Hermann E. Fischer (prix Nobel de chimie en 1902), à l’Institut für Chemie, Université de Berlin, Otto Warburg découvrit que des granules séparés par centrifugation d’un broyat tissulaire catalysent l’oxydation d’acides organiques en présence de cytochrome c. Il avait mis au point un appareil manométrique pour mesurer les échanges gazeux – par exemple, la consommation d’oxygène par des coupes de tissus, en présence de substrats organiques. La préparation de bonnes coupes de tissus est difficile ; compte tenu du coefficient de diffusion de l’oxygène et de la vitesse à laquelle il est consommé par les tissus, l’épaisseur des tranches ne devait pas dépasser une dizaine de couches de cellules. L’utilisation de broyats ou de fractions subcellulaires permettait d’éviter cet inconvénient.
Des tentatives pour isoler les granules dotés d’activité respiratoire (des mitochondries selon l’hypothèse de Kingsbury) furent entreprises en 1933 par Robert R. Bensley et Normand L. Hoerr (The University of Chicago). Bensley était connu pour ses travaux sur le pancréas endocrine : il avait démontré que les îlots de Langerhans constituent un tissu spécialisé, et mis au point une technique de coloration pour distinguer les cellules α des cellules β. Bensley développa une laborieuse technique de purification des mitochondries ; les tissus étaient congelés immédiatement après prélèvement et broyés ; l’homogénat était centrifugé à travers un gradient de densité de solvants organiques (pour limiter la perte par diffusion de molécules hydrosolubles). Les organites ainsi obtenus étaient altérés par l’action des solvants sur les phospholipides membranaires. Vers le milieu des années 1940, Albert Claude et son technicien Rollin Hotchkiss (Rockefeller Institute for Medical Research) utilisèrent une solution de chlorure de sodium pour préparer l’homogénat tissulaire ; ils isolèrent par centrifugation différentielle une fraction de « Gros granules ». A l’examen microscopique, cette fraction contenait des mitochondries altérées. Les solutions salines provoquent l’agrégation des particules subcellulaires. En 1946, Walter Schneider et George Hogeboom remplacèrent la solution de chlorure de sodium par de l’eau distillée : le résultat ne fut pas meilleur ; les organites de forme sphérique ainsi isolés n’étaient pas colorés par le Vert Janus (le colorant vital des mitochondries) et n’avaient pas leur morphologie allongée caractéristique. A la suggestion de George Palade, Hogeboom et Schneider remplacèrent l’eau par une solution de saccharose et le broyage des tissus au mortier et au pilon par l’emploi de l’homogénéiseur en verre mis au point en 1936 par Van Rensselaer Potter et Conrad Arnold Elvejehm (Department of Agricultural Chemistry, University of Wisconsin, Madison). Les organites isolés avaient une activité respiratoire et la morphologie des mitochondries observées au microscope.
Références : Bensley RR, Hoerr NL Studies on cell structure by the freezing-drying method. VI. The preparation and properties of mitochondria(1934)
Hogeboom GH, Schneider WC, Pallade GE The Isolation of Morphologically Intact Mitochondria from Rat Liver (1947)
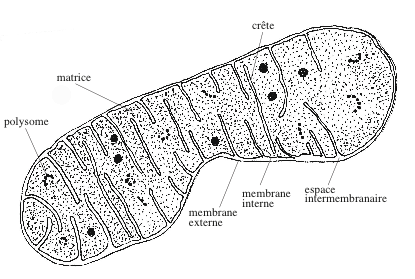
Il fallut attendre l’arrivée du microscope électronique pour découvrir la structure fine des mitochondries. Une compétition s’établit entre le groupe du Rockefeller Institute à New York et celui du Karolinska Institutet, à Stockholm. Après le départ d’Albert Claude du « Rockefeller Institute », les group leaders étaient Keith Porter et George Palade. En microscopie électronique, le laboratoire de New York avait fait œuvre de pionnier. Claude et Porter avaient publié la première micrographie de cellule (un fibroblaste étalé sur une grille) et Claude et Ernest Fullam, le premier cliché d’organites, en 1945. A Stockholm, le physicien Karl Manne G. Siegbahn, prix Nobel de physique en 1924, directeur de l’Institut Nobel de Physique, avait commencé à s’interresser à la microscopie électronique avant la Seconde Guerre mondiale. Siegbahn suivait de près les efforts de ses voisins allemands du groupe d’Ernst Ruska pour mettre au point un microscope électronique. En 1938, Siegbahn décida que la Suède devait entrer dans la compétition et chargea son assistant, Fritiof S. Sjöstrand, d’étudier les applications en biologie de la microscopie électronique. Sjöstrand avait acquis la pratique de la microscopie dans le département de pharmacologie du Karolinska Institutet. Les groupes de New York et de Stockholm se trouvèrent vite en concurrence. Leur différent porta principalement sur les points suivants : la mitochondrie est-elle entourée d’une simple ou d’une double membrane ? Quel est le rôle des cristae ? Sont-elles en continuité avec la membrane interne ?
En 1943, Sjöstrand publia dans la revue Nature les premières micrographies montrant la double membrane. Celles qu’il montra en 1952 à la réunion de l’Electron Microscopy Society of America, étaient plus convaincantes ; on y voyait les cristae, des cloisons transversales qui, selon Sjöstrand, divisaient la matrice mitochondriale en compartiments. C’était un point de désaccord avec Palade pour qui les cristae, percées de pores, n’interrompent pas la continuité de la matrice. A la Third International Conference on Electron Microscopy qui se tint à Londres en 1954, Sjöstrand persista dans l’erreur en soutenant que les pores observés par Palade dans les crêtes étaient des artefacts de conservation des échantillons.
Référence: Sjöstrand F. Electron-microscopic examination of tissues (1943)
Atmungsferment ou déshydrogènases ?
Comme je l’ai dit plus haut, la respiration cellulaire – c’est-à-dire la consommation d’O2 par les tissus – était, au début du XXe siècle, un thème de recherches à la mode. La technique expérimentale consistait à mettre le tissu – un muscle par exemple – en contact avec un substrat et à mesurer la consommation d’O2 (ou la production de CO2) à l’aide de manomètres plus ou moins élaborés. La respiration tissulaire a d’abord été étudié sur des organes entiers, le plus souvent des muscles, puis sur des tranches minces de tissus (0,2 à 0,5 mm d’épaisseur), dans des broyats cellulaires, et dans le système acellulaire mis au point par Batelli et Stern. Elle attira des biochimistes de renom ; en 1910, Otto Warburg avait découvert l’Atmungsferment associé à des granules subcellulaires. Heinrich O. Wieland, professeur de chimie à l’université de Munich, prix Nobel de chimie en 1927, étudiait la réduction de substances organiques in vitro, en présence de catalyseurs chimiques, ou en milieu cellulaire. En 1913, il découvrit que la bactérie Acetobacter convertit l’éthanol en acétate en présence d’un accepteur d’électrons (bleu de méthylène ou une quinone) :
La réaction se déroulant en l’absence d’oxygène, il en déduisit qu’elle était catalysée par une déshydrogénase. En effet, l’éthanol cède deux atomes d’hydrogène qui ont la capacité de réduire de l’oxygène pour former une molécule d’eau :
L’éthanol est plus riche en hydrogène que l’acétate. Dans la réaction (non équilibrée) écrite plus haut, l’éthanol est la forme réduite et l’acétate, la forme oxydée. Pour dire les choses autrement, la réaction redox (réduction/oxydation) :
indique que le transfert d’une molécule d’hydrogène équivaut au transfert de deux électrons. L’éthanol, plus riche en électrons que l’acétate, sert de « donneur » et l’acétate, de « receveur ». Les êtres vivants hétérotrophes tirent leur énergie des électrons fournis par les nutriments.
Dans les années 1900 à 1910, Torsten L. Thunberg (Lunds Universitet) étudia la capacité de tranches de tissus, placées dans un milieu de survie, à oxyder des acides organiques en présence d’un accepteur d’électrons. La consommation d’oxygène de broyats cellulaires était mesurée par la vitesse de décoloration du bleu de méthylène dans un « tube de Thunberg ». Il sélectionna une soixantaine de sels d’acides carboxyliques : lactate, pyruvate (un groupe carboxylique), succinate, malate, fumarate, glutamate (deux groupes), citrate (trois groupes). La vitesse de consommation de l’O2 dépendait de la nature du substrat. Apportant de l’eau au moulin d’Heinrich Wieland, Thunberg conclut que les tissus renferment une variété de déshydrogénases spécifiques de chaque substrat : une déshydrogénase convertirait le succinate en fumarate, une autre convertirait le malate en oxalo-acétate. La déshydrogénation du succinate se faisait à une vitesse particulièrement élevée (la « succinate déshydrogénase » est l’une des quatre déshydrogénases du cycle des acides tricarboxyliques). A l’époque, une virulente controverse opposait Wieland et Warburg ; elle portait sur l’importance respective des oxydases (Warburg) ou des déshydrogénases (Wieland) dans la respiration cellulaire. Thunberg tira de ses résultats une ébauche de voie métabolique. Les atomes d’hydrogène arrachés aux substrats seraient transférés à un accepteur d’hydrogène, qui serait soit un autre métabolite, soit un accepteur artificiel comme le bleu de méthylène.
Frédéric Batelli et son assistante Lina Stern utilisèrent des broyats de tissus dans de l’eau, une solution de NaCl ou du sang, incubés dans des fioles placées un bain-marie à température constante et sous agitation mécanique. Les quantités d’O2 consommées ou de CO2 produites sont mesurées par un manomètre relié aux fioles. Ce système acellulaire permet d’étudier la respiration cellulaire, en faisant varier les paramètres. C’est ainsi qu’ils montrèrent que l’oxydation des acides organiques s’accompagne d’une production de CO2 et d’H2O. Je rappelle qu’à chaque tour de cycle des acides tricarboxyliques, deux molécules de CO2 et deux molécules de H2O sont produites.
Références : Thunberg T Bin Mikrorespirometer 1: Ein neuer Respirationsapparat, um den respiratorischen Gasaustausch kleinerer Organe und Organismen zu bestimmen (1905)
Thunberg T The Hydrogen-Activating Enzymes of the Cells (1930)
Batelli F, Stern L Recherches sur l’activité respiratoire des tissus (1907)
Batelli F, Stern L Recherches sur le mécanisme des oxydations dans les tissus des animaux isolés (1907)
Batelli F, Stern L Recherches sur les processus des combustions élémentaires dans les muscles isolés (1907)
Batelli F, Stern L Oxydation des acides malique, fumarique et citrique par les tissus animaux (1910)
Batelli F, Stern L L’oxydation de l’acide succinique comme mesure du pouvoir oxydant dans la respiration principale des tissus animaux (1910)
Cycle de Krebs
Présent chez tous les organismes aérobies, très conservé parmi les espèces, le cycle des acides tricarboxyliques occupe une place centrale dans le métabolisme intermédiaire. Localisé dans la matrice mitochondriale, les enzymes qui le composent catalysent l’oxydation de groupements acétyl et alimente la chaîne respiratoire en électrons (quatre paires d’e- par tour de cycle et par résidu acétyl oxydé), sous forme de coenzymes réduits à haut potentiel énergétique. Les neuf étapes du cycle (certains en comptent dix) ont été reconstituées par morceaux de séquences par Albert Szent-Györgyi von Nagyrapot, titulaire de la chaire de Chimie médicale à l’Université de Szeged (Hongrie), le biochimiste Carl Martius, Frédéric Batelli et Lina Stern, et par Hans A. Krebs. Szent-Györgyi observa que la consommation élevée en oxygène de tranches de tissu musculaire, ou d’homogénats de muscle pectoral de pigeon, diminue avec le temps d’incubation jusqu’à cesser ; elle est restaurée par l’addition de quantités « catalytiques » d’acides dicarboxyliques en C4, succinate, fumarate, malate et oxaloacétate. Par contre, l’addition d’un acide dicarboxylique en C3 – le malonate – bloque la respiration cellulaire et empêche toute restauration par addition de succinate. En 1925, le neurochimiste Juda H. Quastel avait montré que le malonate inhibe la succinate déshydrogénase. Szent-Györgyi proposa, en 1935, que la séquence des réactions des diacides carboxyliques en C4 :
établisse un lien entre les aliments – protéines, glucides, lipides – donneurs d’hydrogène et la chaine respiratoire mitochondriale. En 1937, Carl Martius et Franz Knoop – le découvreur de la b-oxydation des acides gras – caractérisèrent dans le foie une déshydrogénase catalysant la conversion de citrate (un acide tricarboxylique en C6) en α-cétoglutarate (un acide dicarboxylique en C5), avec réduction de bleu de méthylène. La réaction mettait en jeu deux intermédiaires :
Marchant sur les traces de Szent-Györgyi, Hans A. Krebs et son étudiant post doctorant William Arthur Johnson montrèrent l’addition d’une quantité catalytique de citrate restaurait l’activité respiratoire d’un broyat de muscle pectoral de pigeon. Le citrate, à l’instar des acides dicarboxyliques en C4, se comporte comme un catalyseur. Krebs et Johnson observèrent qu’en présence d’un inhibiteur de la succinate déshydrogénase (malonate), il y a accumulation d’α-cétoglutarate et de succinate :
Regroupant toutes ces données, Martius et Knoop d’une part et Hans Krebs d’autre part pressentirent l’existence d’une voie métabolique. Pour les premiers, la séquence allant du citrate à l’oxalo-acétate était linéaire :
Hans Krebs avait une autre idée, sur laquelle je reviendrai après avoir brièvement rappelé son parcours universitaire et professionnel. Krebs s’est intéressé à la respiration cellulaire dans le laboratoire d’Otto Warburg (Kaiser Wilhelm Institut für Biologie, Berlin-Dahlem), de 1926 à 1930, où il s’initia à la préparation de tranches de tissus et à l’usage du manomètre pour mesurer la consommation ou la production de gaz. En 1932, alors qu’il était l’assistant de Siegfried Tannhauser (Freibourg im Breisgau Universität), il découvrit, avec son étudiant doctorant Kurt Henseleit, le cycle de l’urée, le premier cycle métabolique connu. Au cours de cette séquence de réactions, la désamination oxydative des acides α-aminés fournit deux groupes aminés qui s’unissent à une molécule de CO2 pour former une molécule d’urée (éliminée par les reins chez les animaux uréotéliques) :
Chassé de son poste par la politique raciale du gouvernement national socialiste, Krebs quitta l’Allemagne en 1933 et se réfugia en Grande-Bretagne. L’appui de Sir Frederick Gowland Hopkins, prix Nobel de médecine ou physiologie 1929 et chef de file de l’école de Cambridge, lui permit de poursuivre ses recherches sur le rôle des acides carboxyliques dans la respiration cellulaire. Reprenant le mode opératoire de Szent-Györgyi, Krebs et Johnson (The University of Sheffield) montrèrent que le citrate à faibles doses restaure l’activité respiratoire d’un homogénat de muscle pectoral de pigeon. Krebs émit l’hypothèse que le citrate joue un rôle de catalyseur analogue à celui de l’ornithine et la citrulline (des acides aminés non protéiques) dans le cycle de l’urée. Krebs et Leonard V. Egglestone observèrent une accumulation de citrate lorsqu’on ajoute de l’oxalo-acétate à l’homogénat de tissus musculaire :
En présence de malonate, la production de succinate diminue en anaérobie ; l’inhibiteur de la succinate déshydrogénase empêche la conversion :
En aérobie, la production de succinate augmente ! Ceci peut s’expliquer en supposant que l’oxalo-acétate a « chargé » un chaînon di-carboné (acétyl) donnant ainsi naissance à du citrate qui alimente la séquence de réactions :
Si pour Martius et Knoop, la suite des réactions allant du citrate à l’oxalo-acétate formait une séquence linéaire, ce n’était pas l’opinion de Krebs, fort de son expérience depuis la découverte du Cycle de l’urée. En 1937, Krebs et Johnson décrivirent le Cycle des acides tricarboxyliques (citrate, cis-aconitate, isocitrate) dans un article envoyé à la revue Nature. Faisant preuve d’une myopie confondante, le comité de lecture refusa l’article ; il fut publié dans Experientia, une revue récemment créée. Les données sur le cycle furent complétées par Harland G. Wood et Chester G. Werkman (Iowa State University). Au cours d’expériences avec des tranches de foie de pigeon et des molécules marquées au 13C, ils démontrèrent la formation d’oxalo-acétate à partir de CO2 et de pyruvate (réaction de Wood-Werkman). Cette découverte eut lieu à une époque où il semblait bien établi que seules les plantes et quelques bactéries ont la capacité de fixer le CO2. L’oxaloacétate est ultérieurement réduit en succinate. Ces résultats jetèrent un jour nouveau sur le mode de formation d’un intermédiaire asymétrique en C6, le cis-aconitate. En hommage à ses découvreurs, le Cycle des acides tricarboxyliques est appelé « Cycle de Krebs » ou « Cycle de Szent Gyorgyi-Krebs ». Albert Szent-Györgyi reçut le prix Nobel de médecine ou physiologie 1937, pour la découverte de la vitamine C ; Hans Krebs, auquel Otto Warburg n’avait pas offert son appui pour obtenir un poste permanent parce qu’il le jugeait dépourvu des qualités scientifiques requises pour faire de la recherche, reçut le prix Nobel de médecine ou physiologie 1953.
Références : Quastel JH Dehydrogenations Produced by Resting Bacteria. IV: A Theory of the Mechanisms of Oxidations and Reductions in vivo (1926)
Martius C, Knoop F Der physiologische Abbau der Citronensaure (1937)
Krebs H, Henseleit K Untersuchungen über die Harnstoffbildung im Tierkörper (1932)
Knoop F Der physiologische Abbau der Citronensaure (1937)
Krebs HA, Johnson WA The role of citric acid in the intermediate metabolism in animal tissues (1937)
Krebs HA, Salvin E, Johnson WA The formation of citric and α-ketoglutaric acids in the mammalian body (1938)
Krebs HA, Egglestone LV The effect of insulin on oxidations in isolated muscle tissue (1938)
Wood HG, Werkman CH The utilization of CO2 in the dissimilation of glycerol by the propionic acid bacteria (1936)
J’ai évoqué au début de ce sous-chapitre l’hypothèse formulée par Albert Szent Gyorgy : la séquence des diacides carboxyliques en C4 :
établit un pont entre les aliments donneurs de H2 et la chaîne respiratoire mitochondriale. Comment se fait la transmission des e– ?
Considérons la manière dont l’énergie libérée par le catabolisme du glucose est récupérée ; le catabolisme se déroule dans le cytosol des cellules et chez les bactéries ; en aérobiose, le dernier catabolite du processus, le pyruvate (2 molécules par molécule de glucose), est décarboxylé en acétyle. Pour entrer dans le cycle des acides tricarboxyliques, le groupe acétyle doit être activé afin de franchir la barrière d’énergie qui s’oppose à synthèse de citrate selon la réaction décrite plus bas. L’activation se fait par association à la 4-phosphopanthétéine ; celle-ci, combinée à l’adénosine 3’,5’ diphosphate, constitue le coenzyme A (« A » pour acétylation), un transporteur de groupes acyl dans plusieurs voies métaboliques. Le CoA fut isolé en 1945 par Nathan O. Kaplan et Fritz A. Lipmann (Massachusetts General Hospital) à partir de cellules de levure et sa structure établie par James Baddiley et coll (Lister Institute of Preventive Medicine, London). La phosphopanthétéine est formée de trois molécules liées par deux liaisons de type peptidique, CO-NH : l’acide hydroxy-diméthyl-butyrique, la β-alanine, et la β-mercapto-éthylamine (cystéamine) ; le groupe thiol libre (CoA-SH) intervient dans la liaison thioester avec l’acétyle. La réaction de condensation de l’acétyl et de l’oxaloacétate a été décrite, en 1951, par Severo Ochoa (Department of Pharmacology, New York University College of Medicine) et Feodor Lynen :
Le radical acétyle ne provient pas seulement de la dégradation du pyruvate issu du catabolisme du glucose ; la β-oxydation des acides gras et la désamination acides aminés génère aussi des fragments en C2 qui pénètrent, sous forme d’acétyl-CoA, dans le cycle de Krebs. Une partie de l’énergie libérée au cours du cycle des acides tricarboxyliques est stockée dans la liaison à haute énergie du guanosine triphosphate (GTP). Les e– à haute énergie qui sortent du cycle réduisent les coenzymes NAD+ et FAD. L’oxydation d’un radical acétyle en CO2 produit trois molécules de NADH+H+, une molécule de FADH2 et une molécule d’ATP.
Références : Kaplan NO, Lipmann FA The assay and distribution of coenzyme A (1948)
Chantrenne H, Lipmann F Coenzyme A dependence and acetyl donor function of the pyruvate-formate exchange system (1950)
Beinert H, Von Korff RW, Green DE, Buyske DA, Handschumacher RE, Higgins H, Strong FM A method for purification of coenzyme A (1952)
Chou TC, Lipmann F Separation of acetyl transfer enzymes in pigeon liver extract (1952)
Chou TC, Novelli GD, Stadtman ER, Lipmann F Fractionation of coenzyme A-dependent acetyl transfer systems (1950)
Baddiley J, Thain EM, Novelli GD, Lipmann F Structure of Coenzyme A (1953)
Stern JR, Ochoa S, Lynen F Enzymatic Synthesis of Citric Acid: V. Reaction of Acetyl Coenzyme A (1952)
Coenzymes nucléotidiques
Les êtres vivants tirent leur énergie d’électrons arrachés aux aliments au cours de réactions cataboliques. Les électrons cèdent leur énergie aux complexes de la chaîne respiratoire en passant par un intermédiaire du cycle des acides tricarboxyliques (le succinate) ou par un coenzyme nucléotidique : le diphosphopyridine nucléotide (DPN), identifié en 1906 par Arthur Harden et William Youndin (Lister Institute) dans des extraits de levure. Sa structure, apparentée à celle des vitamines B3 et PP, fut établie par Hans K.A. von Euler-Charpin, co-titulaire avec Harden du prix Nobel de chimie, en 1929. Le DPN est un coenzyme d’oxydoréductase actif dans des voies métaboliques comme la glycolyse ou le cycle des acides tricarboxyliques. En 1961, il a été rebaptisé Nicotinamide Adénine Dinucléotide (NAD). C’est un accepteur ou donneur d’électrons selon la réaction :
ou, en faisant apparaître le transfert d’électrons :
Lorsque la réduction du NAD+ se déroule dans la matrice mitochondriale, le NADH est oxydé par le complexe I de la chaîne des transporteurs d’électrons ; lorsqu’elle a lieu dans le cytosol, le NADH produit ne peut pas délivrer ses électrons directement à l’accepteur mitochondrial, la membrane interne des mitochondries étant imperméable au NADH. Pour franchir cette membrane, les électrons empruntent des transporteurs appelés « navettes ». Elles sont au nombre de deux : la navette du glycérol phosphate et la navette malate-aspartate. Dans le premier cas, du glycérol 3-phosphate transportant les électrons du NADH est généré par la glycérolphosphate déshydrogénase cytosolique (il existe une glycérolphosphate déshydrogénase mitochondriale dont le coenzyme est le FAD) ; les équivalents réducteurs du NADH cytosolique sont délivrés au FAD, avec réduction en FADH2 qui les délivrent à la chaîne respiratoire de la membrane mitochondriale interne. Dans le deuxième cas, la conversion d’oxalo-acétate en malate par la malate déshydrogénase cytosolique s’accompagne du chargement des électrons du NADH sur le malate. Celui-ci franchit la membrane interne. Il est reconverti en oxalo-acétate par la malate déshydrogénase de la matrice mitochondriale en délivrant les électrons au NAD mitochondrial.
En 1932, Otto Warburg et Walter Christian (Kaiser Wilhelm-Institut für Zellphysiologie, Berlin) isolèrent à partir de globules rouges de mammifères un enzyme catalysant l’oxydation d’un sucre-phosphate ; ils le baptisèrent « ferment jaune ». Cet enzyme était formé d’une protéine et d’un pigment jaune, qui fut caractérisé comme étant la riboflavine 5’-phosphate (flavine mononucléotide ou FMN). La couleur jaune des flavoprotéines est dûe à l’absorption de la lumière visible par le noyau flavine. La présence de FMN fut détectée dans un complexe de la chaîne respiratoire, appelé « complexe I » ; il accepte deux électrons fournis par le NADH et les donne à l’ubiquinone par l’intermédiaire d’une protéine à Fe-S. Un autre coenzyme, apparenté au FMN, fut identifié : la flavine adénine dinucléotide (FAD) formé par l’association de FMN et d’acide adénylique. Ce coenzyme est produit sous sa forme réduite, la FADH2, au cours de deux voies métaboliques : le cycle des acides tricarboxyliques et la β-oxydation des acides gras. Au niveau du complexe II de la chaîne respiratoire, le FADH2 transfère à l’ubiquinone deux électrons fournis par le succinate. Le FAD accepte ou donne des électrons selon la réaction :
ou, en faisant apparaître le transfert d’électrons :
Dans la réalité, il n’y a pas de transfert direct d’électrons d’un coenzyme à un accepteur mais « don » d’un anion hydrure H–, formé d’un proton et de deux électrons :
Cytochromes
« La science est sujette à faire de grands sots. »
Molière
Le médecin Charles A. McMunn étudiait au spectroscope le spectre d’absorption de préparations de muscles. Mis au point en Allemagne, cet appareil optique était utilisé par les astronomes pour analyser la composition chimique des corps célestes dans le spectre de la lumière visible. Ernst F.I. Hoppe Seyler (Humbolt Universität zu Berlin) l’utilisa pour suivre les changements de spectre d’absorption de l’hémoglobine en présence d’oxyde de carbone. En 1884, McMunn observa dans les muscles d’insectes un spectre à quatre bandes d’absorption rappelant celui de l’hémoglobine mais en différant dans trois régions. Il en conclut qu’il avait découvert un nouveau pigment, qu’il baptisa « myohématine ». La poursuite de ses travaux conduisit à deux importants résultats : (i) le pigment était ubiquitaire : le spectre découvert dans les muscles d’insectes était présent dans les tissus de toutes les espèces étudiées ; le terme « myohématine » étant trop restrictif, McMunn rebaptisa le nouveau pigment : « histohématine ». (ii) Le spectre d’absorption du pigment changeait lorsque le tissu passait d’aérobiose en anaérobiose. Il émit l’hypothèse que les histohématines jouent un rôle dans la respiration cellulaire. Ces résultats, publiés en 1886, auraient dû éveiller l’intérêt des scientifiques, en particulier d’Hoppe-Seyler, pionnier de l’étude de l’hémoglobine. C’est exactement le contraire qui se produisit. Directeur du Département de biochimie à l’Université de Strasbourg, où il instaura la Chimie physiologique comme discipline académique, fondateur et rédacteur en chef du premier journal de biochime (Zeitschrift für Physiologische Chemie), Hoppe-Seyler déclara, sans avoir effectué la moindre vérification expérimentale, que les pigments de McMunn n’étaient que de l’hémoglobine dégradée ! En 1886, lors de la publication de ses résultats sur les histohématines, McMunn avait 34 ans et Hoppe Seyler, 61. Plutôt que de reconnaître qu’il était passé à côté d’une découverte capitale, le grand homme préféra prononcer une condamnation qui contribua à enterrer pendant quatre décennies la découverte des cytochromes !
En 1925, l’entomologiste et parasitologiste David Keilin examinait au micro-spectroscope les muscles thoraciques d’un parasite du cheval (Gastrophilus intestinalis). Il observa un spectre à quatre bandes, différent de celui de l’hémoglobine. Ce spectre était observable chez d’autres parasites (Calliphora erythrocephala, Galleria mellonella) et chez la levure. De plus, lorsque la culture de levures était agitée, le spectre d’absorption apparaissait et disparaissait. Keilin arriva à la conclusion que les bandes d’absorption a (604 nanomètres), b (564 nm), c (550 nm) et d (521 nm) appartenaient à trois haemochromogènes différents, qu’il appela « cytochromes » a, b et c. C’est en épluchant la littérature scientifique pour la rédaction de son article de 1925 que Keilin s’apperçut que les cytochromes avaient été découverts quarante ans plus tôt par McMunn, sous le nom d’histohématines. Reprenant à son compte l’hypothèse de McMunn sur la fonction respiratoire des pigments, Keilin émit l’hypothèse que les cytochromes étaient des composés hématiniques servant de catalyseur redox ; au cours de la respiration cellulaire, ils étaient réduits par des déshydrogénases et oxydés par un enzyme dont le site actif contiendrait du cuivre. Notons en passant que, devant les résultats de Keilin, Otto Warburg fit preuve du même manque de clairvoyance que Hoppe Seyler vis à vis de ceux de McMunn, en arguant que les cytochromes étaient des ferments dégénérés ne jouant aucun rôle physiologique !
En 1929, Dixon proposa une nouvelle dénomination pour l’enzyme de Warburg : « cytochrome oxydase ». En 1938, à la suite de la découverte par David Keilin et Edward F. Hartree que le donneur d’électrons est le cytochrome c, l’oxydase terminale de la respiration fut renommée : « cytochrome c oxydase ». En 1946, trois groupes de chercheurs travaillant indépendamment, Albert Claude (Rockefeller Institute), Walter Schneider et V.R. Potter (University of Wisconsin), George Hogeboom et Rollin Hotchkiss (National Institutes of Health) montrèrent que le cytochrome c et les enzymes de la respiration cellulaire (cytochrome oxydase, succinate déshydrogénase), sédimentent dans la fraction mitochondriale. De 1948 à 1950, Albert L. Lehninger et son graduate student Eugene P. Kennedy accomplirent une avancée majeure en établissant que quatre systèmes métaboliques : la chaîne des transporteurs d’électrons, le cycle de Krebs, les oxydations phosphorylantes et la β-oxydation des acides gras, sont localisés dans les mitochondries.
En 1930, alors qu’il mesurait la consommation d’oxygène chez des globules rouges (nucléés) d’oiseaux, le biochimiste Vladimir A. Engelhardt (Université de Kazan) nota que l’addition au milieu réactionnel de cyanure – un inhibiteur de la respiration cellulaire – provoque une accumulation de phosphate. Cette observation resta largement ignorée de la communauté scientifique. Engelhardt et Militza Lyubimova découvrirent que la myosine, une protéine présente dans les muscles, catalyse l’hydrolyse d’ATP en ADP et Pi en présence d’O2. En 1934, Vladimir Aleksandrovich Belitser (Palladin Institute of Biochemistry, National Academy of Sciences of Ukraine, Kyiv) étudia l’influence du couple créatine/créatine-phosphate sur l’activité respiratoire de fibres musculaires. Rappelons que la créatine est une petite molécule dont la structure s’apparente à celle des acides aminés (elle en dérive) ; elle est présente dans le cerveau et les muscles sous forme libre ou phosphorylée. Des muscles de batraciens, dont la glycolyse est bloquée par addition d’un inhibiteur (iodoacétate), continuent à se contracter en consommant de la créatine phosphate. Lors d’un effort violent ou prolongé, les muscles striés épuisent leur réserve d’ATP ; ils puisent alors dans leurs réserves en esters phosphorylés (parmi lesquels la créatine phosphate) pour restaurer leur stock d’ATP. La réaction est catalysée par une kinase qui transfert le groupe phosphate de la créatine phosphate sur de l’ADP pour reformer de l’ATP. La créatine est phosphorylée en créatine phosphate par une autre kinase.
Références : McMunn CA Research on Myohematin and the Histohematins (1886)
McMunn CA Further Observations on Myohematin and the Histohematins (1886)
Keilin D On Cytochrome, a Respiratory Pigment Common to Animals, Yeasts ans Higher Plants (1925)
Keilin D, Hartree F Effect of Drying upon the Absorption Spectra of Hemoglobin and its Derivatives (1952)
Keilin D Nature of the Haem-Binding Groups in native and denatured Hemoglobin and Myoglobin (1960)
Engelhardt WA, Lyubimova MN Myosin and adenosine triphosphatase (1939)
La β-oxydation des acides gras
Comme je l’ai rappelé plus haut, la « respiration cellulaire » est l’ensemble des processus métaboliques permettant à un être vivant de tirer des nutriments qu’il ingurgite l’énergie nécessaire à ses besoins vitaux. Dans ce contexte, les acides gras stockés dans le tissu adipeux représentent une importante source d’énergie. A titre de comparaison, l’énergie libre d’oxydation d’un acide aminé (acide glutamique) est de 478 kilocalories par molécule-gramme ; elle est de 686 pour un sucre (glucose) et de 2.338 pour un acide gras (acide palmitique). Une voie catabolique située dans la matrice mitochondriale permet l’oxydation des acides gras avec libération de cette énergie : c’est la « β-oxydation » (par référence au carbone β des acides gras) découverte en 1904 par le biochimiste Franz Knoop (Albert Ludwig Universität Freiburg). Cette voie fournit de l’acétyl-CoA qui sera oxydé dans la matrice mitochondriale par le cycle de Krebs, et des coenzymes réduits (NADH, H+ et FADH2) qui cèderont leurs électrons dans la chaîne respiratoire de la membrane mitochondriale interne. Chez les êtres vivants, la plupart des acides gras ont un nombre pair d’atomes de carbone : acide laurique (C12), acide myristique (C14), acide palmitique (C16)… Ils sont synthétisés et catabolisés par addition ou élagage de composés en C2. Pour le démontrer, Knoop réalisa des expériences d’une ingénieuse simplicité : il nourrissait des rats avec des aliments contenant des acides gras à nombre pair ou impair d’atomes de carbone ; le dernier carbone (carbone ω) portait un radical phényl – une « étiquette » – dont la réactivité permettait l’identification des produits de dégradation dans l’urine des animaux. Knoop observa que la dégradation des acides gras commence par l’enlèvement de fragments en C2 à l’extrémité carboxy-terminale ; il émit l’hypothèse que le mécanisme enzymatique sous-jacent était une β-oxydation.
La confirmation expérimentale de cette hypothèse buta pendant des décennies sur la difficulté à obtenir un système acellulaire fonctionnel d’oxydation les acides gras. En 1943, Luis F. Leloir et Juan M. Munoz (Fundacion Instituto Campomar, Buenos Aires) mirent au point ce système à partir de foie de rat. Ils observèrent le phénomène d’oxydation in vitro et notèrent qu’il était labile et disparaissait rapidement. Albert Lehninger (University of Chicago) montra qu’on pouvait le stabiliser en présence d’ATP ; il en tira la conclusion que pour être oxydés les acides gras doivent préalablement être « activés ». En 1950, Feodor Lynen (Max Planck für Zellchemie, München Universität) et E. Reichart démontrèrent que l’activateur des acides gras n’est pas l’ATP, comme le croyait Lehninger, mais le coenzyme A, qui possède un groupe thiol auquel se lient les acides gras ou les fragments acétyl (en C2). Lehninger confirma les conclusions de Franz Knoop sur la dégradation oxydative des acides gras en composés en C2 et il établit la stœchiométrie de la réaction. La β-oxydation des acides gras est aussi apellée « hélice de Lynen », une allusion au fait qu’une molécule entrant dans cette voie métabolique subit une suite de quatre réactions à la suite desquelles on revient non pas à la molécule initiale comme dans un cycle, mais à une molécule raccourcie de deux unités C (voir chapitre Peroxysomes). C’est ainsi que la dégradation complète d’un acide en C16 se fait en quatre tours d’hélice avec, à chaque tour, production d’un acétyl CoA, qui entrera dans le cycle de Krebs, d’un FADH2 et d’un NADH,H+, qui entreront dans la chaîne respiratoire. L’oxydation d’une molécule d’acide palmitique (C16) produit 130 molécules d’ATP déduction faite des « frais de transport » de l’acide gras du cytosol dans la matrice mitochondriale. En 1948 et 1949, Lehninger et Eugene Kennedy montrèrent que la β-oxydation des acides gras est localisée dans les mitochondries. Les déshydrogénases impliquées furent caractérisées en 1951 par les groupes de Feodor Lynen, de David Green (Institute for Enzyme Research, University of Wisconsin) et de Severo Ochoa (New York University). On a ultérieurement découvert que certaines classes d’acides gras sont oxydés dans d’autres organites subcellulaires (voir chapitre Peroxysomes).
ATP et respiration cellulaire
Au cours des années 1930 et 1940, la biochimie connut une avancée majeure avec l’établissement du lien entre respiration cellulaire et production d’énergie sous forme d’ATP. J’en rappelle brièvement les étapes : en 1929, H. Karl A.H. Lohmann, assistant du biochimiste Otto F. Meyerhof (Kaiser Wilhelm Institute für Biologie, Berlin-Dahlem, prix Nobel de physiologie ou médecine 1922), découvrit l’adénosine triphosphate (ATP). Il crut d’abord que ce nucléotide était spécifique des muscles ; des études ultérieures montrèrent que cette molécule était présente dans toutes les cellules et qu’elle intervenait dans pratiquement tous les processus cellulaires nécessitant un apport d’énergie. Il fut établi que de l’ATP était synthétisé au cours de la glycolyse anaérobie. Cette voie – la première voie métabolique élucidée – ne représente pas chez les cellules eucaryotes, qui vivent en aérobiose, un moyen efficace de produire de l’énergie : les trois premières réactions de la glycolyse consomment autant de molécules d’ATP qu’il y en a de produites (deux) au cours du processus.
J’ai mentionné plus haut que l’emploi de la coloration au Vert Janus de Leonor Michaelis avait révélé l’existence de réactions d’oxydoréduction au sein des mitochondries. En 1933, Herman M. Kalckar commença une thèse de doctorat dans le laboratoire de physiologie d’Ejnar Lundsgaard, à l’université de Copenhague, sous la direction de Fritz A. Lipman, récemment émigré d’Allemagne. En 1937, Kalckar montra que dans un milieu réactionnel contenant un extrait acellulaire de cortex rénal et du fluorure de sodium (pour inhiber la glycolyse anaérobie et les phosphatases cellulaires susceptibles de détruire l’ATP) l’addition d’intermédiaires du cycle des acides tricarboxyliques provoquait une synthèse d’ATP avec réduction d’oxygène. La réaction ne se produisait pas en anaérobiose ou en présence de cyanure (un inhibiteur de la respiration cellulaire). Le lien entre respiration cellulaire et synthèse d’ATP était établi. Les résultats de Kalckar furent confirmés par ceux de V.A. Belitzer et E.T. Tsybakova (Instytut Biokhimyi, Kiev) et de Severo Ochoa (Washington University, St Louis, prix Nobel de physiologie ou médecine 1959), qui avait étudié le métabolisme de la créatine dans le laboratoire de D. Noël Paton, à Glasgow, et chez Otto Meyerhof. Kalckar et Lipman, indépendamment l’un de l’autre, créèrent le concept de « liaison riche en énergie » en référence au fait que l’hydrolyse de la liaison anhydride d’acide phosphorique de l’ATP est très exergonique ; dans les conditions prévalant dans le milieu cellulaire, la variation d’enthalpie libre lors de l’hydrolyse de l’ATP en ADP vaut :
Plutôt que le joule – appartenant au Système International d’Unités -, les biochimistes préfèrent exprimer l’énergie en calories, une unité introduite en 1824 par le physico-chimiste Nicolas Clément. Le transfert du groupe phosphate terminal de l’ATP s’accompagne de la libération d’une énergie libre standard d’hydrolyse de 7,3 kilocalories par mole. Malgré cette richesse en énergie chimique, et contrairement à ce qui est parfois enseigné dans les manuels de biochimie, l’ATP n’est pas une forme de stockage de l’énergie ; son existence est trop brève, sa demi-vie dans la cellule étant de l’ordre de la minute. Il faut plutôt considérer l’ATP comme le transporteur universel d’énergie et le couple ADP/ATP, comme une batterie chimique constamment rechargée par phosphorylation. En 1941, Fritz A. Lipmann (Massachusetts General Hospital, Boston, prix Nobel de médecine ou physiologie 1953), le découvreur du coenzyme A, démontra le rôle central joué par l’ATP dans les transferts d’énergie chimique au sein de la cellule. On estime que la consommation d’un individu en ATP par 24 heures est équivalente à sa masse corporelle.
Mettant à profit l’avancée technologique du fractionnement subcellulaire quantitatif par centrifugation différentielle (voir chapitre « Microsomes ») codifié par Albert Claude (Rockefeller Institute), un groupe de chercheurs incluant Walter C. Schneider et Van Rensselaer Potter (McArdle Laboratory for Cancer Research, University of Wisconsin, Madison), George H. Hogeboom et Rollin D. Hotchkiss (National Institutes of Health, Bethesda) montrèrent que le cytochrome c et les enzymes de la respiration cellulaire (cytochrome oxydase, succinate déshydrogénase) et de l’oxydation des acides gras, sédimentent dans la fraction mitochondriale. De 1948 à 1950, Albert L. Lehninger et son graduate student Eugene P. Kennedy (University of Chicago) mirent le point d’orgue à ces travaux en établissant que la chaîne des transporteurs d’électrons, les oxydations phosphorylantes, le cycle de Krebs et la β-oxydation des acides gras, sont localisés dans les mitochondries.
Références: Lohmann K The pyrophosphate fraction in muscle (1929)
Kalckar HM Phosphorylation in Kidney Tissue (1937).
Belitzer VA, Tsybakova ET Biokhimiya (1939). Tous mes efforts pour me procurer une copie de l’article original ou de sa traduction, ainsi que des renseignements sur ces deux scientifiques, ont été infructueux.
Ochoa S “Coupling” of Phosphorylation with Oxidation of Pyruvic Acid in Brain Tissue (1940)
Claude A Fractionation of mammalian liver cells by differential centrifugation I. Problems, methods, and preparation of extract (1946)
Claude A Fractionation of mammalian liver cells by differential centrifugation II. Experimental procedures and results (1946)
Potter VR The assay of animal tissues for respiratory enzymes; cell structure in relation to fatty acid oxidation (1946)
Hogeboom GH, Claude A, Hotchkiss RD The distribution of cytochrome oxidase and succinoxidase in the cytoplasm of the mammalian liver cell (1946)
Schneider WC, Claude A, Hogeboom GH The distribution of cytochrome c and succinoxidase in rat liver fractions (1948)
Potter VR, Lyle GG, Schneider WC Oxidative phosphorylation in whole homogenates and in cell particles (1951)
Kennedy EP, Lehninger AL Intracellular structures and the fatty acid oxidase system of rat liver (1948)
Kennedy EP, Lehninger AL Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria (1949)
Des électrons en cascades
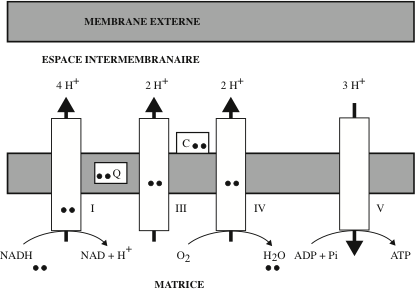
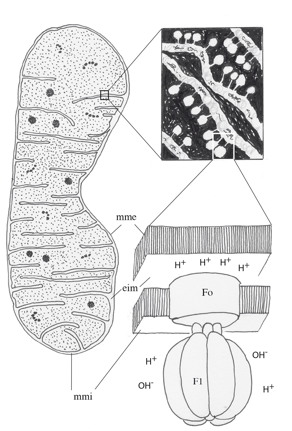
Avec ses quatre compartiments (membrane externe, espace inter-membranaire, membrane interne, matrice) associés à des fonctions différentes, la mitochondrie est un organite complexe. La membrane interne est le site d’un transport d’électrons et de production d’énergie chimique. Cette « chaîne » respiratoire fournit à certaines bactéries aérobies et aux cellules des plantes et des animaux l’essentiel de leur énergie sous forme de molécules d’ATP. La notion de complexes impliqués dans ces processus émergea de la constatation que l’intégrité de la membrane n’est pas nécessaire au maintien d’un transport d’électrons couplé à une synthèse d’ATP. Des fragments de membrane, des préparations membranaires et vésiculaires (Electrons Transfer Particles, ETP) sont capables d’accomplir ces fonctions. Ces complexes sont au nombre de quatre et ils agissent successivement et de manière coordonnée (« coopérative »). Ils sont formés par l’assemblage d’environ 80 polypeptides, presque tous différents les uns des autres. La masse moléculaire de l’ensemble dépasse 2.000.000 de daltons. Les sous-unités protéiques des complexes I, III, IV (et de l’ATP synthase dont il sera question plus loin) sont codées par les génomes nucléaire et mitochondrial ; les sous-unités du complexe II, par le génome nucléaire. Au sein des complexes, une chûte de potentiel d’électrons à haute énergie est couplée à un pompage de protons de la matrice mitochondriale vers l’espace intermembranaire, raison pour laquelle ces machines moléculaires sont appellées « oxydo-réductases-pompes à protons ». Au nombre de quatre, elles sont numérotées de I à IV. Il existe un complexe V dont je parlerai plus loin. Avant de les examiner dans l’ordre, il faut rendre hommage au travail accompli par les chimistes et les physiciens qui ont établi les structures tridimensionnelles des complexes par diffraction des rayons X. Jusque dans les années 1980, cette technique n’avait été appliquée qu’à des protéines solubles (myoglobine, hémoglobine, lysozyme) pour lesquelles il est relativement aisé d’obtenir des cristaux. Le défi était tout autre avec des complexes membranaires essentiellement hydrophobes ; il fut résolu par la préparation de « cristaux bidimensionnels » réguliers, en s’inspirant des travaux effectués sur la rhodopsine, une protéine membranaire des cellules photo-réceptrices de la rétine (les « bâtonnets »). Pour établir la séquence en acides aminés des polypeptides constitutifs des complexes il fallut: (i) préparer des quantités substantielles de mitochondries de cœur de bœuf ; (ii) éliminer la membrane mitochondriale externe par traitement à la digitonine, et la matrice par traitement osmotique ; (iii) isoler la membrane interne par centrifugation ; (iv) solubiliser les complexes membranaires avec des détergents et des agents « chaotropiques » (qui dissocient les structures tertiaire et quaternaire des protéines) ; (v) séparer les polypeptides par chromatographie ; (vi) les séquencer. Il fallut ensuite isoler séparemment chacun des complexes et obtentir des structures suffisamment régulières et ordonnées. Dans les premiers diagrammes de diffraction à faible résolution (6,5 Angström), les détails des structures étaient peu visibles. L’utilisation de sources intenses de rayons X émanant des synchrotrons permit d’obtenir des diagrammes plus lisibles (résolution de 2,8 Angström). La première structure connue fut celle du centre réactionnel photosynthétique de la bactérie pourpre Rhodopseudomonas viridis.
Le point d’entrée dans la chaîne respiratoire des électrons fournis par le coenzyme NADH,H+ est le complexe I pompe à protons (NADH-CoQ réductase, NADH : ubiquinone oxydoréductase). C’est le plus volumineux des quatre complexes ; chez les mammifères, il est composé de 46 sous-unités – dont 14 sont codées par le génome mitochondrial – pour une masse d’environ 1 700 kDa. Sa structure par cristallographie aux rayons X fut établie à partir de différentes sources : mitochondries de cœur de bœuf, Escherichia coli (Ekaterina A. Baranova, Peter J. Holt, Leonid A. Sazanov, Institute of Science and Technology Austria, Klosterneuburg), Thermus thermophilus (Leonid A. Sazanov et Philip Hinchliffe, Medical Research Council, Dunn Human Nutrition Unit, Cambridge), la levure Yarrowia lipolytica (Volker Zickermann et coll. Institute of Biochemistry II, Medical School, Goethe Universität, Frankfurth). Les 2 e– fournis par le NADH sont transportés par une flavine adénine mononucléotide (FMN) dont le groupement prosthétique est la riboflavine (vitamine B2), un transporteur d’hydrogène (deux e– associés à deux H+) :
En acceptant la molécule d’hydrogène fournie par le NADH, le FMN passe successivement de la forme oxydée à la forme semiquinone (FMNH•) puis à la forme réduite (FMNH2). Les e– sont ensuite transférés à une série de protéines à Fe-S de types [2Fe-2S] et [4Fe-4S], puis à l’ubiquinone (coenzyme Q), un transporteur liposoluble à longue chaîne isoprénoïde, localisé à l’interface entre le complexe et la membrane mitochondriale interne. Un composé possédant les propriétés chimiques d’une quinone fut isolé en 1957 à partir de mitochondries de cœur de bœuf par Frederick L. Crane, un collaborateur de David E. Green (Institute for Enzyme Research, The University of Wisconsin) ; il le baptisa « coenzyme Q ». La même année, et indépendamment, Richard A. Morton (Johnston Chair of Biochemistry, University of Liverpool) caractérisa l’ubiquinone (quinone ubiquitaire) dans le foie de rats carencés en vitamines. L’ubiquinone est hydrophobe ; elle fixe deux e– et passe de la forme oxydée à la forme réduite ubiquinol (QH2) en acceptant deux protons issus de la matrice. Le complexe I-pompe à protons transfert 4 H+ de la matrice (mat) dans l’espace intermembranaire (inter).
Références : Hinchliffe P, Sazanov LA Organization of iron-sulfur clusters in respiratory complex I (2005)
Sazanov LA, Hinchliffe P Structure of the Hydrophilic Domain of Respiratory Complex I from Thermus thermophilus (2006)
Baranova EA, Holt PJ, Sazanov LA Projection Structure of the Membrane Domain of Escherichia coli Respiratory Complex I at 8 Å Resolution (2007)
Zickermann V, Wirth C, Nasiri H, Siegmund K, Schwalbe H, Hunte C, Brandt U Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I (2015)
Crane FL, Hatefi Y, Lester RL, Widmer C Isolation of a quinone from beef heart mitochondria (1957)
Rappelons que la membrane mitochondriale interne est imperméable aux protons. Avant de quitter le complexe I, disons quelques mots des « protéines à fer-soufre » (protéines à Fe-S), découvertes par Helmut Beinert, un autre collaborateur de David Green. Elles possèdent au sein de leur structure deux, trois ou quatre atomes de fer liés à des anions sulfure (S2-) appartenant au groupe thiolate de la cystéine, et non à un groupe hème comme dans les cytochromes. En accord avec la variété de leurs structures, leurs potentiels redox sont variés. En 1964, John S. Rieske (Institute for Enzyme Research, University of Wisconsin, Madison) montra que les complexes bc1 et b6f de la chaîne respiratoire renferment une protéine à Fe-S (2Fe-2S) dont un atome de fer est lié à deux résidus histidines. Chaque atome de fer est dans un état d’oxydation qui lui est propre. Les protéines à Fe-S ont la capacité de transporter des électrons (un électron par transfert) et participent à des réactions d’oxydo-réduction dans les mitochondries et les chloroplastes chez les animaux, les plantes et les bactéries.
Référence : Rieske JS, MacLennan DH, Coleman R Isolation and properties of an iron-protein from the (reduced coenzyme Q)-cytochrome C reductase complex of the respiratory chain (1964)
Le complexe II (succinate coenzyme Q réductase) est constitué de quatre sous-unités : (i) la succinate déshydrogénase, le seul enzyme du cycle de Krebs à être localisé dans la membrane mitochondriale interne (les autres sont localisés dans la matrice) ; (ii) une flavoprotéine ; (iii) des protéines à Fe : S ; (iv) une ubiquinone réductase. Le groupe de Douglas C. Rees (Howard Hughes Medical Institute, California Institute of Technology() a déduit la structure du complexe II par cristallographie aux rayons X de la fumarate réductase d’Escherichia coli. Cet enzyme catalyse un transfert d’électrons vers le fumarate, l’accepteur final des électrons chez les organismes anaérobies. La structure cristallographique du complexe II de cœur de porc a été établie à une résolution de 2,4 angstrœm par Fei Sun et ses associés (Institute of Biophysics, Joint Research Group for Structural Biology, Tsinghua University and National Laboratory of Biomacromolecules, Institute of Biophysics, Chinese Academy of Sciences, Beijing).
Le FADH2 délivre au coenzyme Q une paire d’e–, fournie par le succinate, et un H+, via trois centres à Fe-S :
Le complexe II est le second point d’entrée des électrons (fournis par le FADH2) dans la chaîne respiratoire. Le potentiel du couple redox FAD / FADH2 est de -0,20 V contre -0,32V pour le couple NAD+/NADH. Le complexe II ne contribue pas à la formation du gradient de concentration d’ions H+.
Références : Iverson TM, Luna-Chavez C, Cecchini G, Rees DC Structure of the Escherichia Coli Fumarate Reductase Respiratory Complex (1999)
Iverson TM, Luna-Chavez C, Schröder I, Cecchini G, Rees DC Analyzing your complexes: structure of the quinol fumarate reductase respiratory complex (1999)
Sun F, Huo X, Zhai Y, Wang A, Xu J, Su D, Bartlam M, Rao Z Crystal structure of mitochondrial respiratory membrane protein complex II (2005)
Dans le complexe III (Coenzyme QH2-Cytochrome c réductase), comme dans le complexe IV, le transport des e– est assuré, non plus par des flavines comme dans les complexes I et II, mais par des cytochromes. Historiquement, les cytochromes furent les premiers transporteurs d’e– identifiés ; les cytochromes (a, a3 et c) Ils furent découverts par un médecin féru d’expérimentation, Charles A. MacMunn, en observant au spectroscope divers organismes et tissus (notamment des muscles). Les résultats de cet « amateur » furent soumis à une virulente critique de la part d’un grand « professionnel », Felix Hoppe-Seyler, fondateur et rédacteur en chef du Zeitschrift fûr Physiologische Chemie et pionnier de l’étude de l’hémoglobine et de la chlorophylle. C’est ainsi que la découverte des cytochromes tomba aux oubliettes pendant près de quarante ans. Lorsque David Keilin (Molteno Institute for Research in Parasitology, University of Cambridge) découvrit les cytochromes, il eut l’élégance de reconnaître l’antériorité de MacMunn. Ce dernier avait découvert les cytochromes a, a3 et c ; dans les années 40 et 50, Ichiro Y. Sekuzu et Kazuo Okuniki (Department of Biology, University of Osaka) découvrirent les cytochromes c1 et b. Le groupe hème de ces hémoprotéines, constitué d’une porphyrine et d’un atome de fer ionisé, leur confère la capacité d’accepter ou de donner un e– avec passage réversible de l’état ferreux à l’état ferrique.
Références : MacMunn CA VI. Researches on myohamatin and the histohaematins (1886)
Keilin D. On cytochrome, a respiratory pigment, common to animals, yeast and higher plants (1925)
Keilin D A comparative study of turacin and haematin and its bearing on cytochrome (1926)
Keilin D Le cytochrome pigment respiratoire intracellulaire commun aux micro-organismes, aux plantes et aux animaux (1927)
Sekuzu I, Takemori S, Orii Y, Okunuki K Studies on cytochrome a: IV. Reaction of cytochrome a with cytochromes c and c1 (1960)
Takemori S, Sekuzu I, Okunuki K Studies on cytochrome a VII. Physico-chemical properties of purified cytochrome a (1961)
La structure cristallographique de la CoQH2-Cytochrome c réductase a été élucidée chez la levure Saccharomyces cerevisiae et dans les mitochondries de cœur de bœuf par les groupes de Hartmut Michel (Molecular Membrane Biology Department, Max Planck Institute for Biophysics, Frankfurt am Main, prix Nobel de chimie 1988) et de Johann Deisenhofer (Department of Biophysics, The University of Texas Southwestern Medical Center, Dallas, prix Nobel de chimie 1988). Chez les mammifères, c’est un volumineux dimère dont les monomères comportent 11 sous-unités différentes. Les cofacteurs (deux cytochromes b, un cytochrome c1, une protéine de Rieske à 2Fe-2S) sont associés à 3 sous-unités codées par le génome mitochondrial.
Références : Hunte C, Koepke J, Lange C, Rossmanith T, Michel H Structure at 2.3 A resolution of the cytochrome bc(1) complex from the yeast Saccharomyces cerevisiae co-crystallized with an antibody Fv fragment (2000)
Lange C, Hunte C Crystal structure of the yeast cytochrome bc1 complex with its bound substrate cytochrome c (2002)
Zara V, De Blasi G, Ferramosca A Assembly of the Multi-Subunit Cytochrome bc1 Complex in the Yeast Saccharomyces cerevisiae (2022)
Xia D, Yu CA, Kim H, Xia JZ, Kachurin AM, Zhang L, Yu L, Deisenhofer J Crystal structure of the cytochrome bc1 complex from bovine heart mitochondria (1997)
Iwata S, Lee JW, Okada K, Lee JK, Iwata M, Rasmussen B, Link TA, Ramaswamy S, Jap BK Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex (1998)
Solmaz SR, Hunte C Structure of complex III with bound cytochrome c in reduced state and definition of a minimal core interface for electron transfer (2008)
Marten Wikström (Department of Medical Chemistry, University of Helsinki) et Gerald T. Babcock (Department of Chemistry, Michigan State University, East Lansing) ont élucidé le trajet des e– au sein du complexe III, du CoQH2 au cytochrome c. Dans une revue publiée en 1990, Bernard L. Trumpower (Geisel School of Medicine, Dartmouth) a décrit dans le détail le rôle joué par la navette Q/QH2 dans le transfert d’électrons, des complexes I et II vers le complexe III. Présent chez une variété d’organismes, le « protonmotive Q cycle » est le plus important mécanisme de transduction d’énergie. J’ai rappelé, dans un paragraphe précédent, les circonstances de la découverte de l’ubiquinone (1,4 benzoquinone), connue aussi sous l’appellation de coenzyme Q, ou CoQ10, par référence au dix unités isoprène de la chaîne latérale, qui ancre le coenzyme dans la bicouche phospholipidique. Le CoQH2 porte 2H+ et 2e– ; au sein du complexe III, il libère 2 H+ dans l’espace inter-membranaire et fournit un e– au cytochrome c par l’intermédiaire d’une protéine à Fe :S ; il fournit un autre e– au cytochrome b et charge 2H+ venant de la matrice. Le cytochrome c est une protéine soluble de 12.500 daltons dont le cofacteur est un hème de type c ; il est localisé dans l’espace inter-membranaire et transfert un e– vers le complexe IV et l’accepteur final, l’O2. Au total, le complexe III injecte quatre H+ dans l’espace inter-membranaire et réduit deux molécules de cytochrome c.
Références : Wikström M, Babcock GT Cell Respiration. Catalytic Intermediates (1990)
Trumpower BL The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex (1990)
Crane F L, Sun IL, Sun EE The essential functions of coenzyme Q (1993)
Ding H, Daldal F, DuttonPL Ion pair formation between basic residues at 144 of the Cyt b polypeptide and the ubiquinones at the Qo site of the Cyt bc1 complex (1995)
Turunen M, Olsson J, Dallner G Metabolism and function of coenzyme Q (2004)
Darrouzet E, Moser CC, Dutton PL, Daldal F Large scale domain movement in cytochrome bc(1): a new device for electron transfer in proteins (2001)
Le complexe IV (Cytochrome c Oxydase) appartient à la superfamille des oxydases à hème-cuivre. C’est par lui que tout a commencé ! Je parle de la « saga » des travaux sur la respiration cellulaire et la production d’énergie, qui se sont étalées sur des décennies. Le complexe IV est l’Atmungsferment, découvert en 1925 par Otto H. Warburg (prix Nobel de physiologie ou médecine 1931), rebaptisé « cytochrome oxydase » en 1929, partiellement purifié à partir de cœur de bœuf, en 1941, par von Eijiro Yakushiji et Kazuo Okunuki (Iwata Institut fûr Pflanzenbiochemie). Sa structure à l’échelle atomique fut établie par Tomitake Tsukihara et coll. (Institute for Protein Research, Osaka University) ; le complexe IV comporte 13 sous-unités polypeptidiques, dont trois pour la partie catalytique. Le groupe de Hartmut Michel (Molecular Membrane Biology Department, Max Planck Institute for Biophysics, Frankfurt am Main, prix Nobel de chimie 1988) a établi la structure tridimensionnelle du complexe IV (trois sous-unités) de Paracoccus denitrificans. Le complexe IV reçoit quatre e–, transférés depuis le complexe III par le transporteur soluble cytochrome c ; quatre molécules de cytochrome c délivrent, successivement, un e– à une paire d’ions cuivre (Cu2+) puis à l’hème du cytochrome a et enfin au centre catalytique : ions Cu2+ et cytochrome a3. Les quatre e– sont transférés à l’accepteur final O2 ; la chute de potentiel redox entre le cytochrome c et l’O2 est couplée au pompage dans l’espace inter-membranaire de quatre H+ ; quatre autres H+ sont consommés pour former deux molécules de H2O) :
Références : Warburg OH Über Eisen, den sauerstoff-übertragenden Bestandteil des Atmungsferments (1925)
Yakushiji E, Okunuki K Isolierung der a-Komponente des Cytochroms und ihre Eigenschaften (1941)
Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S Structures of metal sites of oxidized bovine heart cytochrome c oxidase at 2.8 Å (1995)
Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S The Whole Structure of the 13-Subunit Oxidized Cytochrome c Oxidase at 2.8 A (1996)
Iwata S, Ostermeier C, Ludwig B, Michel H Structure at 2.8 Å resolution of cytochrome c oxidase from Paracoccus denitrificans (1995)
L’analyse chimique de préparations purifiées a révélé que le rapport protéines/phospholipides de la membrane mitochondriale interne est élevé – le plus élevé des membranes cellulaires – ce qui laissait entrevoir des contacts étroits entre complexes respiratoires individuels. En 1955, Britton Chance et Graham R. Williams (Johnson Foundation for Research in Medical Physics, School of Medicine, University of Pennsylvania) émirent l’hypothèse que la chaîne respiratoire est formée de super-complexes. Bernard L Trumpower (Department of Biochemistry, Darmouth Medical School, Hanover) fut l’un des premiers à caractériser un super-complexe chez Paracoccus denitrificans.
Références : Chance B, Williams GR A Method for the Localization of Sites for Oxidative Phosphorylation (1955)
Berry EA, Trumpower BL Isolation of ubiquinol oxidase from Paracoccus denitrificans and resolution into cytochrome bc1 and cytochrome c-aa3 complexes (1985)
Sone N, Sekimachi M, Kutoh E Identification and properties of a quinol oxidase super-complex composed of a bc1 complex and cytochrome oxidase in the thermophilic bacterium PS3 (1987)
Les progrès techniques dans la séparation et la visualisation des ensembles supramoléculaires ont fait progresser nos connaissances dans le domaine des supercomplexes mitochondriaux. Pour pouvoir les étudier, il faut : (i) préserver les fragiles interactions protéines-protéines ; (ii) éviter les dommages infligés aux structures subcellulaires par les faisceaux d’électrons à haute intensité utilisés en diffraction aux rayons X. La première difficulté a été résolue par l’emploi de l’électrophorèse en gel de polyacrylamide dite « Blue Native ». Alexanne Cuillerier et Yan Burelle (Faculty of Health science, University of Ottawa) ont mis au point une technique combinant les avantages des « Clear Native » et « Blue Native » Polyacrylamide Gel Electrophoresis. Les supercomplexes de la membrane mitochondriale interne sont solubilisés avec un détergent non ionique (digitonine) ; ils sont colorés en bleu par un bref contact avec le colorant anionique Bleu de Comassie (Comassie Brillant Blue). L’électrophorèse est conduite en conditions non dénaturantes (en l’absence de Sodium dodécyl sulfate). La séparation peut être complétée par une électrophorèse bidimensionnelle. Runyu Guo et coll. (Advanced Innovation Center for Structural Biology, School of Life Sciences, Tsinghua University, Beijing) ont utilisé la centrifugation en gradient de densité pour isoler un supercomplexe de mitochondries de cellules humaines en culture.
Références : Jha P, Wang X, Auwerx J Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE) (2016)
Cuillerier A, Burelle Y Hybrid Clear/Blue Native Electrophoresis for the Separation and Analysis of Mitochondrial Respiratory Chain Supercomplexes (2019)
Guo R, Zong S, Wu M, Gu J, Yang M Architecture of Human Mitochondrial Respiratory Megacomplex I(2)III(2)IV(2) (2017)
La seconde difficulté a été résolue par l’usage de la cryomicroscopie électronique (avec une résolution inférieure à 4 Å). Les structures supramoléculaires (respirasomes) ont été étudiées chez les mammifères (homme, bœuf, rat), dans divers organes (cerveau, foie, rein, muscle, cœur, fibroblastes), chez les végétaux, les champignons, les levures, les bactéries et le nématode Caenorhabditis elegans. Pour répondre dans les plus brefs délais aux besoins énergétiques de la cellule, la chaîne respiratoire mitochondriale adopte l’organisation des complexes I à IV en supercomplexes, ce qui limiterait les phénomènes de diffusion. La cohésion au sein de ces structures supramoléculaires est assurée par les interactions fortes entre protéines, et par la présence d’un phospholipide particulier, la cardiolipine. Découverte en 1941 dans le muscle cardiaque par Mary C. Pangborn (Division of Laboratories and Research, New York State Department of Health, Albany), la cardiolipine (glycérol bisphosphatidyl) représente près de 20% des phospholipides de la membrane mitochondriale interne, dont elle assure l’imperméabilité aux protons.
Références : Iwasaki T, Matsuura K, Oshima T Resolution of the aerobic respiratory system of the thermoacidophilic archeon, Sulfolobus sp. Strain 7. I. The archeal terminal oxidase supercomplex is a functional fusion of respiratory complexes III and IV with no c-type cytochrome (1995)
ruel C, Brasseur R, Trumpower BL Subunit 8 of the Saccharomyces cerevisiae cytochrome bc1 complex interacts with succinate-ubiquinone reductase complex (1996)
Boumans H, Grivell LA, Berden JA The respiratory chain in yeast behaves as a single functional unit (1998)
Schagger H, Pfeiffer K Supercomplexes in the respiratory chains of yeast and mammalian mitochondria (2000)
Eubel H, Heinemeyer J, Sunderhaus S, Braun HP Respiratory chain supercomplexes in plant mitochondria (2004)
Reifschneider NH, Goto S, Nakamoto H, Takahashi R, Sugawa M, Dencher NA, Krause F Defining the Mitochondrial Proteomes from Five Rat Organs in a Physiologically Significant Context Using 2D Blue-Native/SDS-PAGE (2006)
Krause F OXPHOS Supercomplexes: Respiration and Life-Span Control in the Aging Model Podospora anserine (2006)
Schäfer E, Dencher NA, Vonck J, Parcej DN Three-dimensional structure of the respiratory chain supercomplex I1II2IV1 from bovine heart mitochondria (2007)
Acin-Perez R, Fernandez-Silva P, Peleato ML, Perez-Martos A, Enriquez JA Respiratory active mitochondrial supercomplexes (2008)
Lombardi A, Silvestri E, Cioffi F, Senese R, Lanni A, Goglia F, de Lange P, Moreno M Defining the transcriptomic and proteomic profiles of rat ageing skeletal muscle by the use of a cDNA array, 2D- and Blue native-PAGE approach (2009)
Sunderhaus S, Klodmann J, Lenz C, Braun HP Supramolecular structure of the OXPHOS system in highly thermogenic tissue of Arum maculatum (2010)
Althoff T, Mills DJ, Popot JL, Kühlbrandt W Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1II2IV1 (2011)
Schäfer E, Seelert H, Reifschneider NH, Krause F, Dencher NA, Vonck J Architecture of active mammalian respiratory chain supercomplexes (2017)
Pangborn M Isolation and purification of a serologically active phospholipid from beef heart (1942)
Ci-dessus, j’ai énuméré les complexes dans l’ordre dans lequel ils interviennent entre le point d’entrée dans la chaîne respiratoire (NADH) et le point de sortie (l’oxygène apporté par la respiration pulmonaire). Pour déterminer cet ordre, on a utilisé deux approches expérimentales: (i) la mesure des potentiels redox des groupes prosthétiques ; le résultat a permis le classement des complexes par ordre de potentiel décroissant; (ii) l’utilisation d’agents découplants (antimicyne A, roténone, cyanure, amytal) qui permet de dissocier le transfert d’électrons de la synthèse d’ATP; ils interrompent le transfert des électrons en un point défini de la chaîne respiratoire (l’antimicyne A, par exemple, interrompt le flux d’électrons entre le NADH et l’ubiquinone). Le grand spécialiste de la mesure des proportions de forme oxydée et de forme réduite des transporteurs était le physico-chimiste Britton Chance (E. R. Johnson Foundation, The University of Pennsylvania). Dans les années 1960, il perfectionna les techniques d’analyse non invasives de matériel biologique (résonance magnétique nucléaire, spectroscopie et fluorométrie) et mit au point d’élégantes techniques spectroscopiques de mesure des formes oxydées et réduites. L’addition d’inhibiteurs modifiait ces proportions. Accessoirement, Chance, qui était un passionné de navigation à voile, remporta une médaille d’or aux Jeux olympiques d’Helsinki, en 1952.
La liaison fonctionnelle entre complexes est assurée par des transporteurs d’électrons mobiles : le coenzyme Q entre les complexes I et III ; le cytochrome c, dans l’espace intermembranaire, entre les complexe III et IV. Le passage des électrons d’un complexe au suivant s’accompagne d’une diminution graduelle de l’énergie libre stockée, ce qui correspond à une augmentation du potentiel redox E°. Si la diminution de E° dépasse le seuil de 300 millivolts, l’énergie libérée permet le pompage de protons de la matrice vers l’espace intermembranaire (les complexes I, III et IV sont des oxydo réductases-pompes à protons).
Bilan
Etablissons le bilan énergétique de la chaîne respiratoire. Au point d’entrée de la chaîne respiratoire, le complexe I catalyse la réaction redox :
A la sortie de la chaîne respiratoire, le complexe IV catalyse la réaction redox :
soit, en additionant les deux réactions :
avec une différence de potentiel de réduction standard :
ce qui correspond à une variation d’énergie libre standard :
Cette quantité d’énergie est théoriquement suffisante pour synthétiser 7 molécules d’ATP (par l’ATP synthase). Chaque fois qu’au sein d’une oxydase-pompe à protons le saut d’énergie électrique est supérieur ou égal à 300 millivolts, des protons sont transférés de la matrice vers l’espace intermembranaire. C’est ainsi que pour chaque molécule de NADH entrant dans la chaîne respiratoire, dix protons sont pompés, créant un potentiel de membrane.
Synthétiser de l’ATP
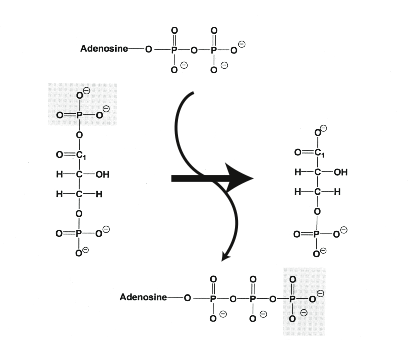
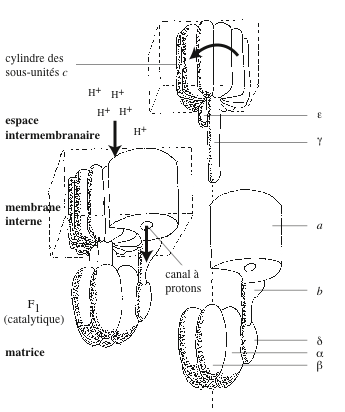
La découverte de la relation entre la chaîne respiratoire et les oxydations phosphorylantes date de la fin des années 1940. Dans les mitochondries, les chloroplastes et chez certaines bactéries, l’énergie d’électrons extraits des nutriments est utilisée pour synthétiser de l’ATP. Lorsque la chaîne respiratoire est alimentée en électrons, de l’ATP est synthétisé. Au cœur de ce processus, il y a un complexe membranaire, l’ATP synthase, une « Splendid Molecular Machine », comme l’appelait Paul D. Boyer. Il fallut plus d’un demi siècle pour comprendre comment fonctionne ce système de conversion d’énergie osmotique en énergie chimique, comment l’ATP synthase utilise la force proton-motrice pour faire de l’ATP. La synthèse d’ATP à partir d’ADP et de phosphate inorganique (Pi ou P)
est une réaction thermodynamiquement défavorable. On dit qu’elle est endergonique ; la variation d’énergie libre ΔG > 0 est positive. Elle ne devient possible que si elle est couplée à une réaction thermodynamiquement favorable :
La liaison riche en énergie d’hydrolyse est symbolisée par le signe ~. La réaction ci-dessus est exergonique ; sa variation d’énergie libre est négative : ΔG < 0. Lorsque les deux réactions sont couplées, la molécule d’eau n’apparait plus dans l’échange :
Si la variation d’énergie libre ΔG des deux réactions est négative et d’ampleur suffisante, de l’ATP est synthétisé. Les composés X~P du métabolisme intermédiaire sont le plus souvent les produits d’estérification d’un thiol (R-SH) et d’un acide carboxylique (R-COOH). Le composé résultant posséde une liaison thioester (-CO-S-) « riche en énergie » dont l’hydrolyse libère 14 kcal par molécule-gramme, la même quantité d’énergie que l’hydrolyse de la liaison pyrophosphate terminale de l’ATP. Un « intermédiaire riche en énergie » fut identifié par Efraïm Racker (New York University Medical School) dans la réaction de conversion d’un dialdéhyde, le glyoxal ou éthanedial : CHO-CHO en acide glycolique (acide hydroxy acétique) : CHOH-COOH, catalysée par la glyoxalase. Il s’agissait d’un dérivé carboxylé du pseudo-tripeptide glutathion (glutamyl-cystéinyl-glycine) possèdant une liaison thioester :
Dans la réaction ci-dessus (non équilibrée) R-SH est le glutathion. Des dérivés de thiols et d’acides carboxyliques interviennent dans d’autres voies métaboliques comme la glycolyse, le cycle de l’acide citrique, le cycle du glyoxylate…
En 1897, Hans E.A. Buchner proposa d’ajouter du saccharose à des broyats de levure, préparés par le chimiste Martin Hahn, pour améliorer leur conservation. Eduard Buchner, le frère de Hans, observa que l’addition de sucre provoquait une fermentation qu’il attribua à la présence d’un « ferment actif », baptisé « zymase ». C’était le premier jalon dans la découverte de la glycolyse anaérobie, la première voie métabolique à être élucidée. Au cours de ce processus, présent chez les bactéries, les mycètes, les végétaux et les animaux, du sucre est transformé en alcool ou en acide lactique et de l’ATP est synthétisé sans intervention (apparente) d’oxygène. Les travaux d’Eduard Buchner (prix Nobel de chimie en 1907), de Carl F. et Gerty T. Cori, de Gustav G. Embden, d’Otto H. Meyerhof, de Jacob K. Parnas, de Carl Neuberg et d’Otto Warburg aboutirent à l’élucidation des dix étapes de ce processus fondamental chez tous les êtres vivants. Le produit final de la glycolyse varie selon les conditions prévalant dans le cytosol des cellules eucaryotes : en aérobiose, le produit final est une molécule de pyruvate (en réalité deux par molécule de glucose) qui entre dans le cycle de Krebs sous forme d’acétyl-CoA ; en anaérobiose, le pyruvate est transformé en lactate (fermentation lactique dans les muscles), ou en alcool (fermentation alcoolique chez les levures).
C’est en étudiant le mode de récupération de l’énergie dans la glycolyse que Paul D. Boyer (Molecular Biology Institute, University of California, Los Angeles) et Efraïm Racker et Isidore Krimsky mirent en évidence, en 1952, l’intervention d’un intermédiaire enzymatique acylé. Au cours de l’étape VI, le groupe aldéhyde du glycéraldéhyde 3-phosphate est oxydé en groupe carboxylate du 3-phosphoglycérate, catalysée par la glycéraldéhyde-3-phosphate déshydrogénase, la seule oxydo-réductase (ou transférase d’électrons) de la voie métabolique. La réaction se déroule en deux étapes au cours desquelles deux intermédiaires réactionnels covalents interviennent : (i) un premier intermédiaire se forme lorsque le groupe sulfidryl d’un résidu cystéine du site catalytique de de la glycéraldéhyde 3-phosphate déshydrogénase est acylé par le groupe carbonyl du glycéraldéhyde 3-phosphate (catalyse covalente) ; cet intermédiaire enzymatique acylé est attaqué par une molécule de phosphate inorganique avec formation de 1,3-bis-phosphoglycérate. C’était la première fois que l’on mettait en évidence le rôle joué par une liaison thiol-ester. (ii) un second intermédiaire phosphorylé se forme lors du tranfert d’un groupe phosphoryl sur l’ADP. La synthèse d’ATP est rendue possible grâce à l’énergie libérée par l’hydrolyse de la liaison anhydride mixte d’acide phosphorique et d’acide carboxylique sur le carbone C1 du 1,3-bis-phosphoglycérate. La différence de potentiel entre le couple redox glycéraldéhyde phosphate/acide phosphoglycérique et le couple redox :
supérieure à 300 millivolts, permet la synthèse électrochimique d’une molécule d’ATP (deux par molécule de glucose). En 1953, Edward C. Slater (Department van Biochemie, Universiteit van Amsterdam), Boyer et d’autres biochimistes se tournèrent vers un mécanisme similaire mettant en jeu deux intermédiaires covalents pour la synthèse d’ATP dans les mitochondries. L’hypothèse du couplage chimique avec un intermédiaire riche en énergie, ou hypothèse « chimio-chimique » orienta les recherches des biochimistes pendant deux décades.
Dans le laboratoire de Carl et Gerty Cori (Washington University School of Medicine), Mildred Cohn, pionnière de l’emploi des radioisotopes en biologie, montra en 1963 qu’en présence de mitochondries s’opère un échange rapide d’oxygène (18O) entre le phosphate inorganique et l’eau. Boyer s’inspira d’un protocole expérimental similaire avec 18O et 32P et montra que l’ensemble des oxydations phosphorylantes était réversible. Il attribua l’échange rapide d’oxygène à l’hydrolyse d’un intermédiaire covalent riche en énergie par du phosphate inorganique. Le domaine F1 de l’ATP synthase catalyse la réaction réversible :
comme le montre le calcul des constantes d’équilibre des vitesses de synthèse et d’hydrolyse. Lorsque la réaction ci-dessus fonctionne dans le sens de l’hydrolyse d’ATP en présence d’oxygène, le Pi peut incorporer jusqu’à quatre atome d’18O. En faisant abstraction des nucléotides, dans la réaction :
l’échange d’18O refléte quantitativement la vitesse de formation et d’hydrolyse de l’ATP. Avec le complexe F1, l’échange se déroule sans apport d’énergie. Avec des particules submitochondriales (complexe FoF1), l’échange se déroule en présence d’agents découplants. L’incorporation de plusieurs atomes d’18O dans Pi révèle que la liaison γ−pyrophosphate a été hydrolysée et reformée plusieurs fois. D’autre part, la vitesse d’échange d’18O est plus élevée que la vitesse de réversibilité de la réaction, ce qui est compatible avec l’intervention d’un intermédiaire covalent dont le clivage par une molécule de Pi donnerait de l’ATP. Il fallut plus d’une décennie pour comprendre que cette interprétation n’était pas la bonne et que l’échange d’oxygène était dû au relargage d’une molécule d’ATP fixée sur un site catalytique de l’ATP synthase.
Dans les années 1960, Boyer poursuivi sa quête infructueuse en caractérisant une protéine mitochondriale fixant du 32P sur un résidu histidine et servant d’intermédiaire entre le phosphate inorganique et l’ATP. Il ne s’agissait pas de l’intermédiaire des oxydations phosphorylantes recherché mais d’un intermédiaire de la succinyl CoA synthetase qui, dans le cycle de Krebs, synthétise de l’ATP (ou du GTP) à partir d’un nucléotide diphosphate et de Pi.
Hypothèse chimio-osmotique
« Max Planck (…) remarked that a new scientific idea does not triumph by convincing its opponents, but rather because its opponents eventually die. »
Peter Mitchell
Le ton vengeur de la phrase de Peter Mitchell citée en exergue est une conséquence de l’opposition qu’il dut affronter lorsqu’il présenta son hypothèse chimio-osmotique. En biologie, de grandes découvertes qui ont radicalement changé le cours de nos connaissances ont souvent fait l’objet de publications de taille modeste. En 1953, la description de la structure en double hélice de l’ADN par James Watson et Francis Crick fit l’objet d’un article de deux pages dans la revue Nature. Ce fut également le cas pour l’article de Peter D. Mitchell, dans lequel il critiquait l’hypothèse chimio-chimique en faisant remarquer que les enzymes de la glycolyse anaérobie sont des protéines cytosoliques, donc solubles alors que les complexes de la voie respiratoire dépendent pour leur fonctionnement de l’intégrité de la membrane ; toute altération mécanique ou chimique (détergents) de la membrane mitochondriale interne supprime le transport des électrons et la synthèse d’ATP. Mitchell mettait en doute l’intervention d’un intermédiaire chimique. Dépassant le stade de la critique, il proposa une élégante hypothèse mécanistique. L’énergie nécessaire à la synthèse d’ATP proviendrait d’une force proton-motrice créée par un gradient de concentration en protons de part et d’autre de la membrane interne ; un mécanisme analogue à la chimio-osmose (diffusion de molécules d’eau à travers une membrane) utiliserait l’énergie cinétique du passage de protons à travers la membrane ; ce passage se ferait à travers le complexe de l’ATP synthase et l’énergie libérée par le flux des protons vers la matrice mitochondriale serait couplée à la synthèse d’ATP. L’hypothèse chimio-osmotique provoqua un scepticisme général dans la communauté des « mitochondriaques ». Ceux-ci considéraient avec suspicion tout ce qui venait de Mitchell, ce franc-tireur de la biochimie qui finançait lui-même ses recherches (avec l’argent de sa femme) sans recourir à l’argent public. Avec sa collaboratrice Jennifer Moyle, ce scientifique hors normes avait fondé une structure de recherche privée : les Glynn Research Laboratories. Au fil du temps, des résultats expérimentaux étayant l’hypothèse chimio-osmotique furent publiés. Mitchell et Moyle démontrèrent une corrélation entre le déplacement des électrons le long de la chaîne de respiratoire et le pompage de protons de la matrice vers l’espace intermembranaire.
Références: Mitchell PD Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism (1961)
Mitchell PD, Moyle J Stoichiometry of proton translocation through the respiratory chain and adenosine triphosphatase systems of rat liver mitochondria (1965)
L’appellation « adénosine triphosphatase » dans le titre de l’article de Mitchell et Moyle rappelle que le fonctionnement du complexe est réversible ; il fonctionne comme une ATP synthase lorsque les protons passent de l’espace intermembranaire vers la matrice, et comme une ATPase lorsque les protons suivent le chemin inverse.
Alors qu’il séjournait dans le laboratoire d’Efraïm Racker (Biochemistry Department, Cornell University), André T. Jagendorf (College of Agriculture and Life Sciences, Cornell University) prit connaissance de l’hypothèse de Mitchell. Il la transposa au cas de la photophosphorylation avec synthèse d’ATP dans les chloroplastes (voir le chapitre « Chloroplastes »). En 1966, Jagendorf et Ernest G. Uribe purifièrent des thylakoïdes de feuilles d’épinard et les incubèrent à l’obscurité dans une solution de pH acide ; les protons franchirent la membrane par diffusion passive et s’accumulèrent dans les disques jusqu’à l’équilibre avec le milieu. Lorsque les thylakoïdes chargés en protons furent incubés dans l’obscurité, dans une solution de pH plus élevé, en présence d’ADP et de 32Pi, Jagendorf et Uribe observèrent une accumulation d’AT32P dans le stroma ; le relâchement des protons s’accompagnait d’une synthèse d’ATP. Walther Stoeckenius (University of California, San Francisco) et Ephraïm Racker s’associèrent pour préparer des liposomes dans la membrane desquels ils insérèrent de la bactériorhodopsine et la F1Fo-ATPase. Racker et ses collaborateurs maîtrisaient les techniques de purification de l’ATPase de cœur de bœuf et de préparation des liposomes. Le succès de l’expérience reposait sur le bon vouloir des deux protéines à adopter l’orientation correcte au moment de leur insertion in vitro dans la membrane liposomiale. Et le miracle se produisit ! Après éclairement, des protons furent pompés dans les liposomes ; en présence d’ADP et de Pi dans le milieu, de l’ATP fut synthétisé !
Références: Jagendorf AT, Uribe EG ATP formation caused by acid-base transition of spinach chloroplasts (1966)
Racker E, Stoeckenius W Reconstitution of purple membrane vesicle catalyzing light-driven proton uptake and adenosine triphosphate formation (1974)
En 1977, le modèle chimio-osmotique de Peter Mitchell était à peu près unanimement accepté. L’énergie libérée par le transport d’électrons dans la chaîne respiratoire mitochondriale, dans les photosystèmes chloroplastiques ou par la bactériorhodopsine membranaire est utilisée pour pomper des protons à travers une membrane (imperméable aux protons) avec génération d’un potentiel électrostatique. L’énergie générée par le retour des protons à travers le complexe membranaire de l’ATP synthase produit de l’ATP. Le vainqueur de la « Great Chemi-osmotic War » (selon l’expression d’un concurent malheureux) reçut le prix Nobel de Chimie en 1978. Restait à élucider le mécanisme de fonctionnement de l’ATP synthase. Mitchell proposa une interaction directe entre le flux de protons et le site catalytique de l’enzyme ; la réalité allait se révéler bien plus sophistiquée.
Avec le concept de la catalyse rotationnelle, Paul D. Boyer proposa un modèle très différent de celui de Mitchell. L’énergie délivrée par le flux de protons provoquerait un changement de conformation du site catalytique de l’ATP synthase, détachant ainsi une molécule d’ATP fermement liée à ce site. Cette hypothèse lui fut inspirée par le modèle de la myosine. Les mouvements cellulaires sont rendus possible par l’interaction de deux protéines filamenteuses : l’actine et la myosine. La myosine est un complexe protéique abondant dans le cytoplasme des cellules contractiles des muscles lisses et des muscles striés. Elle est formée de deux chaînes lourdes (2.000 résidus d’acides aminés) comprenant, de l’extrémité carboxy-terminale à l’extrémité amino-terminale, la queue – des hélices α surenroulées, sauf à leurs extrémités carboxy-terminales -, le cou – deux chaînes légères associées à chacune des deux chaînes lourdes -, et la tête – deux domaines globulaires. L’ensemble a la forme d’un bâtonnet de 180 nanomètres de long. Le domaine globulaire est un moteur moléculaire possédant un « site nucléotides » (ATP ou ADP + Pi) et un « site actine ». L’actine globulaire (actine G) est associée à un cation divalent (Ca2+ ou Mg2+) et à une molécule d’ATP dont l’hydrolyse déclenche l’association des molécules d’actine G en ploymère hélicoïdal d’actine filamenteuse (actine F). La progression de la myosine le long des filaments d’actine se fait par l’intermédiaire de ses domaines globulaires. Les têtes de myosine ayant fixé une molécule d’ADP + Pi sont en « configuration haute énergie », liées au filament d’actine. Après relarge d’ADP + Pi la tête revient en « configuration basse énergie » et le filament d’actine coulisse par rapport à celui de myosine. La fixation d’une molécule d’ATP par les domaines globulaires de la myosine entraîne un changement conformationnel qui les détache du filament d’actine. Les cinétiques de la réaction d’échange
dans l’ATPase des têtes de la myosine et l’ATP synthase présentent des analogies. Boyer en déduisit que l’ATP synthase devait avoir un « site nucléotide » analogue à celui de la myosine. Il proposa un concept catalytique dans lequel l’énergie délivrée par le flux de protons provoquerait un changement de conformation du site catalytique de l’ATP synthase, ce qui aurait pour effet de détacher une molécule d’ATP fermement liée au site nucléotide.
L’hypothèse de la catalyse conformationnelle, publiée en 1973 par Paul Boyer, Richard L. Cross et William Momsen, rencontra d’emblée une certaine opposition ; elle fut réfutée par Peter Mitchell et l’article fut refusé par le Journal of Biological Chemistry ! Boyer étant membre de la National Academy of Sciences, il réussit à le faire accepter par les Proceedings de cette société sous le titre : « A New Concept for Energy Coupling in Oxidative Phosphorylation Based on a Molecular Explanation of the Oxygen Exchange ». Tenant compte des critiques formulées par Mitchell, Boyer publia en 1975 une version plus élaborée de son hypothèse. Je n’entrerai pas dans le détail des expériences de cinétique enzymatique réalisées par les collaborateurs de Boyer. Ce qui finit par imposer son hypothèse, c’est qu’un certain nombre d’anomalies étaient difficilement explicables dans le cadre de la cinétique classique des enzymes solubles. Par exemple : (i) en absence d’ADP dans le milieu d’incubation, l’ATP ne se détachait pas ; (ii) en absence d’ATP dans le milieu d’incubation, la réaction :
s’arrêtait. Celik Kayalar, dans le laboratoire de Paul Boyer, proposa d’expliquer l’une de ces anomalies en faisant appel au concept de coopérativité, c’est-à-dire en supposant que le comportement du site ATP était influencé par un site ADP + Pi voisin. Le concept de régulation allostérique de l’activité enzymatique, proposé au milieu des années 1960 par Jacques Monod, Jean-Pierre Changeux et Jeffries Wyman (Institut Pasteur, Paris), met en jeu des protéines oligomériques formées de protomères symmétriquement semblables. Chaque protomère posséde un site catalytique fixant le substrat, un site allostérique fixant un agoniste et un cycle inhibiteur ; la fixation de l’agoniste sur le site allostérique provoque un changement de conformation du protomère dont le site actif peut fixer le substrat. Nous verrons plus loin que le changement de conformation subi par le site catalytique de l’ATP synthase ne répond pas exactement à ce modèle. En 1977, Celik Kayalar et Jan Rosing proposèrent un modèle pour l’ATP synthase de particules sub-mitochondriales à (au moins) deux sites catalytiques agissant de manière séquentielle et coopérative. En 1981, Boyer présenta le postulat de la catalyse conformationnelle aux Gordon Research Conferences. Le modèle à trois sites catalytiques fut proposé l’année suivante par Paul Boyer, Michael J. Gresser et Jill A. Myers dans un article intitulé « Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site mode ». Les trois sites, disposés en cercle, subissent des changements successifs de conformation (nous verrons plus loin comment). L’apport énergétique du flux de protons permet la fixation d’ADP+Pi sur un site et le relargage d’ATP fortement fixé sur un autre site.
Le modèle expérimental de la bactériorhodopsine
Halobacterium est une Archée vivant dans les milieux à forte concentration en sels. Elle tire son énergie de la capture de photons solaires par la bactériorhopsine, une protéine de 26 kilodaltons comportant 7 hélices α transmembranaires. En 1971, Walther Stoeckenius et Dieter Oesterhelt (Université de Californie, San diego) montrèrent que la bactériorhodopsine est une pompe à protons. Elle possède un chromophore, le rétinal, qui confère à la membrane d’Halobacterium sa couleur pourpre. L’absorbtion d’un photon de couleur verte fait passer le rétinal à l’état excité (isomérisation cis/trans). La bactériorhopsine prend alors la conformation d’une pompe à protons active. Lorsqu’il est éclairé, Halobacterium halobium éjecte des protons dans le milieu, créant ainsi un gradient électrochimique pouvant atteindre 300 millivolts. Les protons éjectés reviennent dans la cellule en empruntant un canal traversant une ATP synthase membranaire. L’énergie libérée par le passage des protons est couplée à une synthèse d’ATP.
La bactériorhopsine forme, dans la membrane plasmique d’Halobacterium, des amas de molécules compactées en cristal bidimensionnel. Cet arrangement est suffisamment ordonné pour permettre l’étude de la structure cristallographique aux rayons X. L’étude d’Halobacterium halobium a fourni des éclaircissements sur le mécanisme de conservation de l’énergie couplé à un transport unidirectionnel de protons, à travers une membrane, contre un gradient électrostatique. Les mécanismes chez Halobacterium et dans la membrane mitochondriale interne présentent des différences : (i) dans le cas de la bactériorhopsine l’énergie nécessaire au transfert de protons est fournie par l’isomérisation cis/trans du rétinal ayant absorbé un photon ; pour les oxydoréductases mitochondriales, l’énergie est libérée par les chûtes de potentiels entre deux transporteurs d’électrons. Les transporteurs sont assemblés dans la chaîne respiratoire par ordre de potentiel redox décroissant. (ii) La bactériorhodopsine est une molécule de taille modeste (26 kilodaltons) ; les oxydoréductases mitochondriales sont des complexes de grande taille : 240 kilodaltons pour le monomère du complexe des cytochromes bc1 ou de la cytochrome oxydase. En dépit de ces différences, le mécanisme du pompage des protons reste essentiellement le même. Dans la bactériorhodopsine, les résidus d’acides aminés impliqués ont été identifiés : deux aspartates, deux glutamates, une arginine et une base de Schiff au niveau du rétinal. Ils oscillent de l’état protoné à l’état déprotoné, véhiculant ainsi le proton d’un résidu à l’autre, selon une séquence déterminée. Dans les complexes I et IV, comme pour la bactériorhodopsine, le pompage unidirectionnel de protons implique des changements de conformations.
« The Fundamental Particles of Biology »
En 1961, Takuzo Oda et David E. Green (Institute for Enzyme Research, University of Wisconsin) demandèrent à Humberto Fernandez-Moran (Mixter Laboratories for Electron Microscopy, Massachusetts General Hospital, Boston) d’examiner au microscope électronique des membranes internes de mitochondries de cœur de bœuf colorées négativement à l’acide phosphotungstique. Les clichés révélèrent la présence de particules élémentaires (inner membrane spheres) de 9 à 10 nm de diamètre, rattachées à la membrane par une courte tige. Cette observation fut confirmée par D. F. Parsons et par Walther Stoeckenius (The Rockefeller University). Des particules semblables furent observées dans les membranes de chloroplastes et chez Escherichia coli. Green supposa qu’elles représentaient les unités, jusque-là hypothétiques, du système mitochondrial de transduction de l’énergie ; pour souligner leur importance, il les baptisa « The Fundamental Particles of Biology ». L’élucidation de leur structure atomique tridimensionnelle et de leur mode de fonctionnement représente une avancée majeure en biologie. Parmi ceux qui y contribuèrent, je placerai sur le devant de la scène les groupes d’Efraïm Racker (Biochemistry Department, Cornell University), Peter Mitchell (Glynn Research Ltd, Bodmin, Cornwall), Paul D. Boyer (Molecular Biology Institute, University of California, Los Angeles), et John E. Walker (Medical Research Council, Laboratory of Molecular Biology, Cambridge). Mitchell reçut le prix Nobel de chimie en 1978, Boyer et Walker furent colauréats de ce prix en 1997. Malgré l’importance de l’ensemble ses contributions (dont la découverte de la voie des pentoses phosphate), Racker ne figure pas parmi les lauréats ; faut-il y voir une conséquence de son retard à détecter les fraudes scientifiques de son collaborateur, Max Spector ?
Références: Fernandez-Moran H, Oda T, Blair PV, Green DE A macromolecular repeating unit of mitochondrial structure and function. Correlated electron microscopic and biochemical studies of isolated mitochondria and submitochondrial particles of beef heart muscle (1964)
Efraïm Racker et Yasuo Kagawa firent le rapprochement entre les particules de Fernandez-Moran et l’enzyme purifié en 1960 par Maynard E. Pullman et coll ; après traitement de la membrane mitochondriale interne par des protéases, ils avaient isolé une ATPase. Les protéases avaient coupé le lien réunissant le complexe enzymatique F1 (Fraction 1), au domaine Fo (Fraction oligomycine ; un antibiotique inhibant l’ATP synthase) intégré dans la membrane mitochondriale interne. Depuis les travaux de Pullman, la fonction du domaine F1 a été élucidée : sous la pression du potentiel de membrane provoqué par l’accumulation de protons pompés dans l’espace inter-membranaire par les complexes de la chaîne respiratoire, le domaine F1 laisse échapper des protons vers la matrice et fonctionne comme une synthase, catalysant la phosphorylation d’ADP en ATP. Dans le cas d’une inversion de la force proton-motrice, le domaine F1 fonctionnerait comme une ATPase, pompant des protons avec consommation d’ATP, comme c’est le cas chez les organismes chimiotrophes. Une étape de solubilisation par le cholate (un sel d’acide biliaire) fut nécessaire pour libérer le domaine polaire Fo de la membrane mitochondriale interne ; sa structure partielle fut établie par Yasuo Kagawa et Racker en 1966 ; ce domaine est formé d’un anneau de sous-unités c (10 à 15).
Références: Pullman ME, Penefsky HS, Datta A, Racker E Partial Resolution of the Enzymes Catalyzing Oxidative Phosphorylation. I. Purification and Properties of Soluble, Dinitrophenol-stimulated Adenosine Triphosphatase (1960)
Kagawa Y, Racker E Partial Resolution of the Enzymes Catalyzing Oxidative Phosphorylation. X. Correlation of morphology and function in submitochondrial particles (1966)
Les données expérimentales, notamment de microscopie électronique, avaient révélé que l’ATP synthase F1Fo est composée d’une partie F1 faisant saillie dans la matrice mitochondriale et contenant les sites catalytiques, et d’une partie Fo, membranaire, contenant le canal à protons. L’ATPase F1Fo de mitochondries de cœur de bœuf fut purifiée par Alan E. Senior (Department of Biochemistry and Biophysics, University of Rochester Medical Center) et Harvey S. Penefsky (Department of Biochemistry and Molecular Biology, State University of New York, Syracuse); cinq polypeptides furent caractérisés : a (55.250 daltons), b (51.700), g (30.140), d (15.000), e (5.630). Les premières images de ce moteur nano-moléculaire, qui fournit l’essentiel des besoins en ATP de la cellule, furent obtenues dans le groupe d’Egbert Boekema (Rijksuniversiteit Groningen, Biomolecular Sciences and Biotechnology Institute) au prix d’un fastidieux travail d’analyse statistique des données de centaines de clichés de microscopie électronique de particules colorées négativement. Boekema et coll. obtinrent ultérieurement une représentation tridimensionnelle de l’ATPase F1Fo en utilisant la cryo-microscopie électronique d’échantillons congelés dans l’azote ou l’hélium liquides, combinée à la tomographie.
Références : Senior AE, Brooks JC Studies on the mitochondrial oligomycin-insensitive ATPase. I. An improved method of purification and the behavior of the enzyme in solutions of various depolymerizing agents (1970)
Brooks JC, Senior AE Methods for purification of each subunit of the mitochondrial oligomycin-insensitive adenosine triphosphatase (1970)
Penefsky HS Preparation of beef heart mitochondrial ATPase (1979)
Boekema E, Berden JA, van Heel M Structure of mitochondrial F1-ATPase studied by electron microscopy and image processing (1986)
Jan Pieter Abrahams et coll. établirent la structure cristallographique de la F1-ATPase de mitochondries de bœuf à une résolution de 2.8 Å. Les trois sous-unités catalytiques β ont des conformations et un contenu en nucléotide différents. Ces observations sont en accord avec un modèle catalytique de l’ATP synthase dans lequel les trois sous-unités β changent de conformation à chaque étape du cycle catalytique. Le passage d’une conformation à l’autre pourrait être provoqué par la rotation du bloc α3 β3 autour du domaine en hélice α de la sous-unité γ. Les biochimistes avaient montré que les parties F1 et Fo sont reliées par un filament, long de 45 Å, constitué des sous-unités γ et ϵ. Les sous-unités δ et b participent aussi à cette liaison. En 1997, Stephen Wilkens et coll. déterminèrent la structure en hélices α d’un fragment de la sous-unité δ, par spectroscopie par résonance magnétique nucléaire. Les premières structures cristallographiques obtenues par diffraction des rayons X dans le groupe de John E. Walker (Medical Research Council Laboratory of Molecular Biology, Cambridge), et dans d’autres laboratoires, ne concernaient que des fragments de la partie catalytique (F1-ATPase) : sous-complexes a3b3gde-c10 de Saccharomyces cerevisiae (Stock et coll.) ; a3b3gde de mitochondries de cœur de bœuf (Gibbons et coll.), a3b3g de chloroplastes d’épinards (Groth et Pohl). Une structure cristallographique de l’ATPase F1Fo partiel (7 chaînes polypeptidiques, 22.722 atomes) de Saccharomyces cerevisiae fut publiée en 1999. La structure de l’ATPase F1, associée à une protéine régulatrice inhibant l’activité ATPase, fut réalisée par Elena Cabezon en 2003.
Références : Abrahams P, Leslie AG, Lutter R, Walker JE Structure at 2.8 A resolution of F1-ATPase from bovine heart mitochondria (1994)
Wilkens S, Rodgers A, Ogilvie I, Capaldi RA Structure and arrangement of the δ subunit in the E. coli ATP synthase (ECF1Fo) (1997)
Stock D, Leslie AG, Walker JE (1999) Molecular architecture of the rotary motor in ATP synthase (1999)
Gibbons C, Montgomery MG, Leslie AG, Walker JE (2000) The Structure of the central stalk in bovine F1-ATPase at 2.4 A resolution (2000)
Groth G, Pohl E The structure of the chloroplast F1-ATPase at 3.2 A resolution (2001)
Cabezon E, Montgomery MG, Leslie AGWL, Walker JE The structure of bovine F1-ATPase complexed with its regulatory protein, IF1 (2003)
En réunissant les données obtenues par l’analyse de deux structures tridimensionnelles, John L. Rubinstein, dans le laboratoire de John E. Walker, utilisa la cryo-microscopie électronique de particules isolées de mitochondries de coeur de bœuf pour déterminer la disposition des différents composants au sein de l’ATPase F1, à une résolution de 32 Å. Le sous-complexe F1-c10 contient les tige centrale et périphérique ; le sous-complexe Fo est composé de deux domaines : l’un correspondant à l’anneau des sous-unités c et l’autre, à la sous-unité a, la portion transmembranaire de la sous-unité b et des protéines membranaires intégrales. La flexibilité de la tige périphérique selon qu’elle interagit ou pas avec la partie α–β de F1 suggère qu’elle pourrait jouer le rôle de stator au cours de la synthèse ou de l’hydrolyse de l’ATP. John E. Walker reçut le prix Nobel de chimie 1997.
Référence : Rubinstein JL, Walker JE, Henderson R Structure of the mitochondrial ATP synthase by electron cryomicroscopy (2003)
La notion que les nano-moteurs rotatoires existent dans la membrane sous forme de super-complexes émergea avec la mise à la disposition des chercheurs de l’électrophorèse sur gel de polyacrylamide en conditions non dénaturantes – natives (blue-native polyacrylamide gel electrophoresis, « native PAGE »). On a établi, par examen au microscope électronique de particules isolées, la structure des complexes I monomérique et II dimérique d’Arabidopsis, et du complexe dimérique de l’algue Polytomella. Pour Alexander Hahn et coll. et Karen M. Davies et coll. (Department of Structural Biology, Max Planck Institute of Biophysics, Frankfurt am Main), la courbure de la membrane mitochondriale interne (cristae) au niveau des dimères d’ATP synthase est imposée par la pliure particulière de la portion membranaire de l’ATP synthase.
Références : Hahn A, Parey K, Bublitz M, Mills DJ, Zickermann V, Vonck J, Kühlbrandt W, Meier T Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology (2006)
Davies KM, Anselmi C, Wittig I, Kühlbrandt Structure of the yeast F1Fo-ATP synthase dimer and its role in shaping the mitochondrial cristae (2012)
La théorie chimio-osmotique formulée par Peter Mitchell en 1961 repose sur l’existence d’un gradient électrochimique de protons de part et d’autre de la membrane mitochondriale interne. Les chutes de potentiel entre complexes transporteurs d’électrons de la membrane mitochondriale interne actionnent le pompage de protons dans l’espace inter-membranaire ; d’autre part, à la différence de la membrane interne, imperméable aux protons (elle est riche en cardiolipines), la membrane mitochondriale externe est perméable aux protons libérés dans le cytoplasme par le métabolisme intermédiaire ; leur accumulation dans l’espace inter-membranaire crée un gradient électrochimique dû à l’addition de deux facteurs : (i) la polarité de la membrane : la face en contact avec l’espace inter-membranaire est négative ; celle tournée vers la matrice est positive (différence de charge : environ 80 mV) ; (ii) la concentration en H+ dans l’espace inter-membranaire par rapport à la matrice (environ 2 unités de pH). L’hypothèse de Mitchell implique que pour diffuser de l’espace inter-membranaire vers la matrice, les ions H+ traversent l’ATP synthase. D’abord rejetée par ses pairs, l’hypothèse de Mitchell reçut une première validation expérimentale lorsque John E. Walker et ses collaborateurs du Laboratory of Molecular Biology à Cambridge, établirent la structure atomique tridimensionnelle de l’ATP synthase à une résolution de 2.8 Å. En 1999, ce fut le tour de la structure de l’ATP synthase de Saccharomyces cerevisiae, un assemblage de 13 sous unités (masse moléculaire : environ 600 000 daltons) réparties en domaines structurels et fonctionnels : la F1ATPase comporte une tête globulaire catalytique α(3) β(3) traversée par la tige centrale asymétrique γ(1) ; la Fo ATPase est formée principalement de protéines membranaires ; elle comporte en particulier le domaine a, solidaire de la tige périphérique b(2), δ(1), en contact avec les protomères α et β du domaine F1 et orientée vers la matrice mitochondriale, le stroma des chloroplastes ou le cytosol des bactéries. L’ATP synthase est un moteur moléculaire composé d’un stator, avec les sous-unités a(1) de Fo, b(2), δ(1), α(3) β(3) de F1, et un rotor composé de l’anneau des sous-unités c(9-12) et de la tige γ(1), δ(1), ε(1).
Un autre résultat expérimental étaya de façon convaincante l’hypothèse de Mitchell ; il fut obtenu par André T. Jagendorf dans le laboratoire d’Efraïm Racker, à Cornell University (voir « Hypothèse chimio-osmotique ») ; en 1966, Jagendorf et Uribe ont mis en évidence une synthèse d’ATP in vitro par des chloroplastes chargés en protons.
Références: Abrahams JP, Leslie AG, Lutter R, Walker JE Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria (1994)
Stock D, Leslie AGW, Walker JE Molecular Architecture of the Rotary Motor in ATP Synthase (1999)
Dickson VK, Silvester JA, Fearnley IM, Leslie AG, Walker JE On the structure of the stator of the mitochondrial ATP synthase (2006)
Rees DM, Leslie AG, Walker JE The structure of the membrane extrinsic region of bovine ATP synthase (2009)
Rubinstein JL, Walker JE, Henderson R Structure of the mitochondrial ATP synthase by electron cryomicroscopy (2003)
Lau WC, Baker LA, Rubinstein JL Cryo-EM structure of the yeast ATP synthase (2008)
« A splendid molecular machine »
En 1974, Paul D. Boyer proposa la théorie du mécanisme de changement de liaison (Binding Change Mechanism), plus connue sous l’appellation de catalyse rotationnelle. Les trois postulats qu’il avança pour expliquer le fonctionnement de l’ATP synthase furent validés par la mise en évidence de la « turbine moléculaire rotatoire » qui, chez les mitochondries, les chloroplastes et certaines bactéries, est au cœur du système de conversion d’énergie osmotique en énergie chimique. Le fonctionnement de l’ATP synthase est déclenché par la rotation du cylindre des sous-unités c, entraînant dans son mouvement la sous-unité assymétrique γ. Les polypeptides du cylindre c, enchâssé dans la membrane, comportent deux hélices α constituées d’acides aminés hydrophobes à l’exception d’un résidus aspartate (Asp) en position 61. L’ensemble des Asp 61 forme un anneau situé vers le milieu de la bicouche phospholipidique, ce qui empêche la rotation spontanée du cylindre. Lorsqu’un proton traverse le canal (en réalité les deux demi-canaux) de la sous-unité a, il neutralise la charge d’un Asp 61. L’aspartate protoné entre en contact avec la bicouche hydrophobe et la rotation de l’anneau c est enclenchée entrainant la sous-unité γ qui lui est attachée ; celle-ci pénètre dans l’hexamère α(3) β(3) maintenu en position fixe par l’ensemble des sous-unités du stator, l’empêchant ainsi de suivre le mouvement de rotation. Il se produit une conversion d’énergie osmotique du gradient électrochimique en énergie mécanique de transconformation des sous-unités β ; elles passent par trois conformations qui se succèdent dans l’ordre : lâche (fixation d’ADP + Pi), serrée (condensation en ATP), ouverte (libération de l’ATP) ; il y a en permanence une sous-unité β dans chacune de ces trois conformations et une molécule d’ATP est synthétisée à chaque rotation du rotor de 120° (3 ATP par rotation de 360°). De l’énergie mécanique est consommée pour charger en énergie chimique une molécule d’ATP, le seul organophosphate rechargeable par couplage chimio-osmotique. Dans les conditions qui prévalent dans la cellule, la variation d’enthalpie libre lors de l’hydrolyse de l’ATP en ADP est ΔG = -51,8 kJ/mole
En 1997, Hiroyuki Noji, Ryohei Yasuda, Masasuke Yoshida et Kazuhiko Kinoshita Jr. (Research Laboratory of Resources Utilization, Tokyo Institute of Technology, Yokohama) firent la démonstration visuelle directe que la F1-ATPase est un moteur moléculaire rotatoire – comme l’énorme complexe (plus de 100 polypeptides) du flagelle bactérien. Ils fixèrent sur une surface plane recouverte d’une couche de nickel les sous-unités β du sphéroïde α(3) β(3) par une queue poly-histidine. Ils attachèrent par une liaison covalente un long filament d’actine fluorescente à la sous-unité γ émergent du sphéroïde. Les mouvements rotatoires du bras d’actine purent être directement observés au microscope à fluorescence. On estime que le rotor effectue 130 révolutions par seconde.
Références: Dahms AS, Boyer PD Occurrence and Characterisation of 18O-exchange Reactions Catalyzed by Sodium-and Potassium-dependent Adenosine Triphosphatases (1972)
Boyer PD The ATP synthase–a splendid molecular machine (1997)
Noji H, Yasuda R, Yoshida M, Kinoshita Jr. K Direct observation of the rotation of F1-ATPase (1997)
Boyer PD What makes ATP synthase spin ? (1999)
Schnitzer MJ Doing a rotary two-step (2001)
Bilan
Etablissons le bilan énergétique en partant de l’oxydation du glucose. Après passage par la glycolyse (+ 2 ATP), le cycle de Krebs (+ 2 ATP) et la chaîne respiratoire (+ 34 ATP) une molécule de glucose produit théoriquement 38 molécules d’ATP. Le bilan doit être minoré (30 à 32 molécules d’ATP) pour tenir compte du coût énergétique du transport de certaines molécules du cytosol vers la matrice mitochondriale (pyruvate).
Cytochrome c mitochondrial et apoptose
Sous ses différentes formes, la nécrose cellulaire et tissulaire est un phénomène connu de longue date. Elle est le plus souvent consécutive à un épisode traumatique et se traduit par le gonflement et l’éclatement des cellules. Le cytoplasme répandu affecte les cellules voisines, ce qui entraîne une inflammation et une réaction immunitaire. L’apoptose fut identifiée comme un phénomène de mort cellulaire différent de la nécrose à la suite des travaux des embryologistes et des pathologistes.
En 1951, le biologiste Alfred Glücksmann (Strangeways Research Laboratory, Cambridge) fit paraître un article très documenté intitulé « Cell Deaths in Normal Vertebrate Ontogeny ». Cette revue, publiée dans un journal à diffusion restreinte, les Biological Reviews of the Cambridge Philosophy Society, passa largement inapperçu aux yeux des non-spécialistes de la biologie du développement des vertébrés. Glücksmann y introduisait l’idée qu’au même titre que la mitose, et à l’opposé, la mort cellulaire était un mécanisme naturel de régulation des populations cellulaires, à l’origine de la formation des tissus et des organes.
Dix ans plus tard, le phénomène de mort cellulaire programmée allait réapparaître comme une conclusion des travaux des pathologistes sur les dommages infligés à des tissus soumis à différentes formes de stress : ischémie (John Foxton R. Kerr, University College, Hospital Medical School, London), traitement par un hydrocarbure polycyclique cancérigène (Alastair R. Currie, University of Aberdeen, Ecosse), sevrage en facteur de croissance (Andrew H. Wyllie, University of Aberdeen). L’examen au microscope optique ou électronique révèla la présence d’aggrégats de chromatine dans le noyau et d’une fragmentation du cytoplasme avec formation de corps apoptotiques, des vésicules limitées par une membrane et contenant des organites. Les corps apoptotiques sont immédiatement phagocytés par les cellules voisines ; ils subissent une ségrégation dans les phagosomes, puis une digestion après fusion des phagosomes avec des lysosomes.
John F.R. Kerr décrivit, en 1965, ce qu’il appelait « shrinkage necrosis » dans un article intitulé « A Histochemical Study of Hypertrophy and Ischaemic Injury of Rat Liver with Special Reference to Changes in Lysosome » publié dans le Journal of Pathology and Bacteriology. En 1972, après avoir comparé leurs résultats avec ceux des embryologistes, John Kerr, Alastair Currie et Andrew Wyllie avancèrent l’hypothèse de mort cellulaire programmée dans un article publié dans le British Journal of Cancer : « Apoptosis: A Basic Biological Phenomenon with Wide-Ranging Implications in Tissue Kinetics ». Pendant une décennie, le mécanisme de l’apoptose à l’échelle moléculaire ne suscita aucun intérêt de la part des biochimistes. A partir des années 1980, un certain nombre de biochimistes commencèrent à s’y intéresser. Selon l’origine des signaux, intracellulaires ou extracellulaires, qui déclenchent le phénomène, on dénombre trois mécanismes d’activation: (i) par la mise en jeu des récepteurs du Facteur de nécrose tumorale (TNF, Tumor Necrosis Factor) de la membrane plasmique (voie extrinsèque); (ii) par la mise en jeu des protéines de la super-famille Bcl-2 (B Cell Lymphona 2) (voie intrinsèque ou mitochondriale). C’est le mode principal d’activation de l’apoptose; (iii) par la mise en jeu du Facteur inducteur d’apoptose (AIF, Apoptosis Inducing Factor), une flavoprotéine localisée dans l’espace inter-menbranaire mitochondrial. Sa libération dans le cytosol est déclenchée par les protéines de la super-famille de Bcl-2. C’est le mode d’activation de l’apoptose pendant le développement embryonnaire.
Quel que soit son mode de déclenchement, l’apoptose se traduit in fine par l’activation d’enzymes protéolytiques à cystéine appelés caspases (Cysteine ASPartic proteASEs). Ces protéases sont étudiées depuis la découverte, dans les années 1990, de l’Interleukin 1 Converting Enzyme (ICE). Elles sont présentes dans le cytosol sous forme de pro-enzymes inactifs. Leur activation est déclenchée par la formation de l’apoptosome. La protéine cytosolique pro-apoptotique Bax (de la super-famille Bcl-2) s’unit à elle-même. L’homodimère Bax-Bax se fixe sur la membrane mitochondriale externe et provoque la formation de mégapores (MTP, Mitochondrial Permeability Transition Pores) par lesquels s’échappe le cytochrome c et l’AIF. Dans le cytosol, le cytochrome c se lie à l’AIF ; celui-ci subit un changement conformationnel qui expose un domaine amino-terminal appelé CARD. Ceci déclenche le recrutement du pro-enzyme de la caspase-9, en présence d’ATP (Dans la voie extrinsèque, c’est la procaspase-8 qui est recrutée par les ligands des récepteurs du TNF). Ainsi se forme le complexe de l’apoptosome qui déclenche la cascade enzymatique des caspases effectrices (caspases 3 et 7) responsables de la digestion des protéines de structure, de la fragmentation du cytosquelette, de la dégradation de l’ADN nucléaire et du démantèlement final de la cellule.
Pathologie mitochondriale
Avant d’aborder ce thème, il me semble utile de rappeler que les protéines mitochondriales sont codées par l’ADN nucléaire et par le petit ADN mitochondrial: chez l’homme, 16.569 paires de bases contre trois milliards pour l’ADN nucléaire. Je rappelle, également que l’ADN mitochondrial est transmis selon les lois de l’hérédité maternelle. Chez l’homme, il contient 37 gènes codant pour des ARN (22 ARNt et 2 ARNr) et pour 13 protéines des complexes de la chaîne respiratoire: complexe I (sous-unités 1, 2, 3, 4, 4L, 5 et 6), complexe III (cytochrome b), complexe IV (sous-unité 2 et 3) et complexe V (sous-unités 6 et 8). Le système nerveux central étant un grand consommateur d’énergie, il est affecté au premier chef par les dysfonctionnements de la chaîne respiratoire. C’est ainsi que le Syndrome MELAS ou le Syndrome de Leigh (Encéphalomyopathie nécrosante subaiguë) sont des affections neurologiques graves, au pronostic sévère, qui affectent les très jeunes enfants ou les jeunes adultes. Il existe une variante du Syndrome de Leigh de transmission maternelle.
Dans le Syndrome MELAS, on observe un déficit du fonctionnement des complexes I et/ou IV. Sur le plan clinique, ce syndrome se traduit par une myopathie affectant les fibres musculaires rouges, une encéphalopathie et de l’acidose lactique (le fonctionnement déficient de la chaîne respiratoire provoque une conversion du pyruvate en lactate). La plupart des patients présentent une mutation du gène codant l’ARNtLeu.
Le chromosome IX porte un groupe de six gènes (SURF-1 à 6) étroitement associés au sein du Surfeit gene cluster. Le facteur SURF-1, localisé dans la membrane mitochondriale interne, joue un rôle essentiel dans l’assemblage des protéines du complexe IV de la chaîne respiratoire (cytochrome c oxydase). Certains individus portent une mutation homozygote du gène nucléaire SURF-1, transmise par la mère de manière autosomique récessive. Cette mutation provoque une déficience en cytochrome oxydase (complexe IV) associée au Syndrome de Leigh.