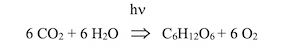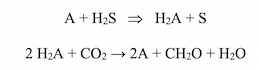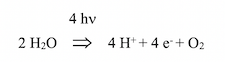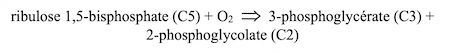Chloroplastes
« (Oxygenic photosynthesis) was the last of the great inventions of microbial metabolism, and it changed the planetary environment forever. »
Paul Falkowski
« La vie peut se définir, du point de vue thermodynamique, comme un mode particulier de transformation de l’énergie solaire »
Christian de Duve
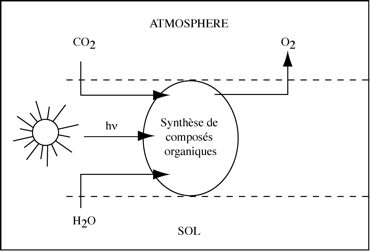
Si notre bonne vieille Terre ne ressemble pas à la planète Mars, nous le devons à des cyanobactéries (algues bleu vert) photosynthétiques qui ont libéré de l’oxygène dans l’atmosphère. La Grande Oxydation débuta il y a 2,4 milliards d’années et s’étendit sur 500 millions d’années, entraînant un bouleversement de la composition de l’atmosphère terrestre : d’un mélange d’H2O et de CO2 à un mélange de N2 (78 %) et d’O2 (21 %). Les cyanobactéries primitives utilisaient une machinerie moléculaire réduite à un centre réactionnel, qui, en se perfectionnant au fil des temps, a permis aux cyanobactéries contemporaines et aux eucaryotes (algues, plantes, certains protistes) de prendre le relais des cyanobactéries primitives.
Il faut cependant rappeler que la machinerie photosynthétique n’a pas toujours conduit à la production d’O2. La photosynthèse primitive, apparue il y a environ 3,8 milliards d’années, était anoxygénique, ce qui ne l’a pas empêchée de fournir l’énergie nécessaire au développement des premières cellules vivantes en convertissant l’énergie des photons solaires en travail chimique. Chaque année, le monde végétal et le phytoplancton utilisent environ 0,1% de l’énergie solaire arrivant sur notre Terre (1017 kcal) pour fixer 1,2*1011 tonnes de CO2 atmosphérique dans des composés organiques.
Le terme « photosynthèse » fut inventé à la fin du XIXe siècle par le botaniste Charles R. Barnes. Les ingrédients nécessaires furent identifiés, chez les plantes vertes, à la fin du XVIIIe siècle. A cette époque existait un véritable engouement pour l’étude des gaz ; le gaz carbonique (CO2), appelé « air fixe » ou « air vicié », fut découvert par le chimiste et physicien Joseph Black dans les années 1750 ; l’oxygène, ainsi dénommé par Antoine Laurent de Lavoisier, fut détecté en 1773 par Karl Wilhelm Scheele, apprenti apothicaire puis pharmacien avant de devenir un chimiste de renom. En 1774, Joseph Priestley découvrit l’air déphlogistiqué (oxygène) en décomposant par chauffage de l’oxyde de mercure. Priestley avait aussi montré, en 1771, que l’air confiné dans une enceinte close, et « vicié » par la flamme d’une bougie ou par la respiration animale, pouvait être « restauré » par une plante (en l’occurrence, un rameau de menthe), permettant la survie d’une souris placée dans une enceinte fermée. Selon la doctrine du phlogistique, conçue au XVIIe siècle par le médecin et alchimiste Joachim J. Becher, les corps combustibles brûlent parce qu’ils contiennent un principe inflammable : le phlogiston. Dans l’expérience de Priestley, l’air de l’enceinte avait été vicié par le phlogiston libéré par la combustion de la bougie. Le rameau de menthe avait restauré l’air en retirant le phlogiston. Priestley passa dix années de sa vie à étudier ce phénomène sans comprendre le rôle de la lumière.
Références : Barnes CR The theory of respiration (1904)
Lavoisier AL Sur la combustion en général (1778)
Scheele KW Traité chimique de l’air et du feu (1781)
Scheele KW Supplément au Traité chimique de l’air et du feu (1785)
Priestley J Experiments and Observations on Different Kinds of Air (1774–86)
Becher JJ Physica subterranea (1669)
Le médecin et botaniste Jan Ingen-Housz, ancien étudiant à l’Université catholique de Louvain, publia, en 1779, un ouvrage au titre kilométrique, dans lequel il soulignait l’importance de l’éclairement par la lumière solaire des parties vertes des plantes, en particulier des feuilles. Compte tenu de la modestie des moyens expérimentaux mis en œuvre, il parvint à une série de conclusions d’une remarquable pertinence : (i) le carbone présent dans les plantes est d’origine atmosphérique ; (ii) les feuilles sont le siège d’un phénomène aboutissant à la scission du gaz carbonique en carbone et oxygène ; (iii) l’oxygène est libéré dans l’air ambiant tandis que le carbone se combine à l’eau (absorbée par les racines) pour former des hydrates de carbone. Influencé, comme nombre d’autres botanistes, par l’ouvrage d’Ingen-Housz, le prêtre Jean Senebier établit que, chez les végétaux, la présence d’« air fixe » (CO2) est nécessaire à la restauration de l’air. Le rôle de l’eau fut démontré, en 1804, par le chimiste et botaniste Nicolas Théodore de Saussure ; il établit aussi une relation stœchiométrique entre consommation de CO2 et production d’O2.
Références : Ingen-Housz J Experiments upon Vegetables, Discovering Their great Power of Purifying the Common Air in the Sun-shine, and of Injuring it in the Shade and at Night. To Which is Joined, A new Method of examining the accurate Degree of Salubrity of the Atmosphere (1979)
Senebier J Mémoires physico-chimiques sur l’influence de la lumière solaire pour modifier les êtres des trois règnes de la Nature, et surtout ceux du règne végétal (1782)
Senebier J Recherches sur l’influence de la lumière solaire pour métamorphoser l’air fixe en air pur par la végétation (1783)
De Saussure NT La formation de l’acide carbonique est-elle essentielle à la végétation ? (1797)
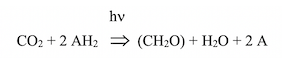
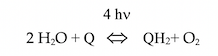
En suggérant, en 1842, que les plantes convertissent l’énergie lumineuse en énergie chimique, le médecin Julius Robert von Mayer a introduit le concept de « conversion de l’énergie » ; ce concept, étayé par le résultat des travaux de Julius von Sachs sur la production d’amidon dans les chloroplastes, fut une étape importante pour l’élucidation du mécanisme de la photosynthèse. Incidemment, je rappelle que c’est von Mayer qui a énoncé le premier principe de la thermodynamique, sur la conservation de l’énergie. Dans les années 1930, Cornelis Van Niel proposa l’équation :
dans laquelle la contribution de la lumière solaire est représentée par l’énergie du photon :
h est la constante de Planck et ν, la fréquence de la lumière en cycles par seconde (s). L’énergie E exprimée en joules (J) dépend de la longueur d’onde de la lumière (λ) :
(c) est la vitesse de la lumière : 3.108 m/s ; λ est exprimée en m. Pour la lumière rouge (λ = 700 nm = 10.7-9 m), un einstein de photons (1 photon X nombre d’Avogadro) libère une énergie de 41 k.cal (la synthèse d’une mole d’ATP consomme 7,3 kcal). Les plantes consomment de l’ATP pour synthétiser des hydrates de carbone (CH2O)n selon l’équation générale de la photosynthèse :
Références : von Sachs J Ueber den Einfluss des Tageslichtes auf die Neublidung unt Entfaltung verschiedener Pflanzenorgane (1863)
von Sachs J Handbuch der Experimentalphysiologie der Pflanzen (1865)
En résumé, la photosynthèse est un processus qui, en présence de lumière et de chlorophylle, consomme de l’eau et du CO2 pour synthétiser des hydrates de carbone et libérer de l’oxygène. D’où vient l’oxygène libéré ? de l’eau ou du gaz carbonique ? Le chimiste Justus von Liebig, comme la plupart de ses contemporains, pensait que l’oxygène était fourni par le dioxyde de carbone. Pour Mathias Schleiden, l’oxygène provenait de l’eau, plus facilement dissociable que le gaz carbonique. Il fallut patienter un siècle et demi pour avoir la réponse à cette question. A la fin des années 1930, Samuel M. Ruben (University of California, Berkeley) et le physicochimiste Martin Kamen (University of California, San Diego), sous la supervision du physicien nucléaire Ernest O. Lawrence (Berkeley Radiation Laboratory), cultivèrent des algues de l’espèce Chlorella en présence d’isotopes radioactifs. L’eau et le gaz carbonique étaient « marqués », soit avec l’isotope naturel de l’oxygène (16O), soit avec l’isotope lourd (18O). Après éclairement des plantes cultivées en présence de H218O et de C16O2, les gaz collectés contenaient de l’oxygène 18O2 :
Comme l’avait prédit Mathias Schleiden, l’O2 est fourni par H2O. La photosynthèse peut être vue comme un clivage photolytique de l’eau. Nous verrons plus loin que cette appellation est incorrecte. Rappelons que Martin Kamen et Samuel Ruben ont découvert, en 1940, le radio-isotope à longue vie C14 ; cette découverte eut un impact considérable sur la recherche en biochimie métabolique.
Référence : Ruben S, Randall M, Kamen M, Hyde JL Heavy oxygen (18O) as a tracer in the study of photosynthesis (1941)
En 1895, Frederick F. Blackman (University of Cambridge) montra que les échanges gazeux entre les plantes et l’atmosphère se font à travers les pores des feuilles, appelés « stomates ». Blackman est aussi l’auteur de la loi des facteurs limitants (law of limiting factors) applicable aux réactions multifactorielles, comme la photosynthèse. En 1905, avec son assistante Gabrielle L.C. Matthaei, il mesura la vitesse de fixation du CO2 en fonction de divers paramètres : température, concentration en CO2, intensité lumineuse. A faible intensité et concentration élevée en CO2, la vitesse de fixation du CO2 n’était pas influencée par une augmentation de la température. A intensité élevée et concentration limitée en CO2, la vitesse augmentait avec l’augmentation de température jusqu’à une limite à 35°C. Ils en conclurent que la photosynthèse comporte (i) des réactions thermochimiques sensibles à la température ; au-delà d’un certain seuil d’éclairement, elles sont indépendantes de l’intensité lumineuse. La vitesse de fixation du CO2 n’est limitée que par la concentration en CO2. (ii) des réactions photochimiques indépendantes de la température.
Référence : Blackman FF, Matthaei GLC Experimental researches in vegetable assimilation and respiration. IV.—A quantitative study of carbon-dioxide assimilation and leaf-temperature in natural illumination (1905)
Dans une série d’articles publiés de 1937 à 1940, Robert Hill (Department of Biochemistry, University of Cambridge) a décrit les expériences conduites sur des chloroplastes isolés, soumis à un éclairement : en présence d’H2O, et en absence de CO2 , ces organites libèrent de l’O2, prouvant ainsi que l’origine de l’O2 est l’eau et non le dioxyde de carbone.
La réaction photosynthétique est une oxydo-réduction. Dans les chloroplastes, comme dans les mitochondries et chez les organismes mettant en œuvre des phénomènes énergétiques, l’énergie provient de réactions d’oxydo-réduction. H2O fournit des électrons qui réduisent un accepteur d’électrons artificiel (A), le ferricyanure de potassium dans l’expérience de Hill. Il utilisa également le 2,6-dichlorophénol indophénol (« réactif de Hill ») qui passe de bleu (état oxydé) à incolore (état réduit). CO2 ne figure pas dans l’équation ci-dessus. Dans son expérience, Hill a dissocié les deux aspects de la photosynthèse : libération d’O2 au cours de la phase d’éclairement (« réaction de Hill ») et réduction de CO2. Je rappelle, en passant, qu’au cours des oxydo-réductions, les électrons ne voyagent pas seuls :
En l’absence de lumière (phase sombre) et en présence de CO2, on observe une fixation de CO2. J’ai montré, dans un paragraphe précédent, l’équation de la photosynthèse proposée par Cornelius B. Van Niel (Hopkins Marine Station, Stanford University). Ce microbiologiste étudiait les bactéries sulfureuses pourpres et vertes. En 1932, il démontra que la photosynthèse est une réaction d’oxydo-réduction sous la dépendance de la lumière, au cours de laquelle CO2 est réduit par un donneur d’hydrogène oxydable :
Références : Hill R Oxygen Evolved by Isolated Chloroplasts (1937)
Hill R Oxygen Produced by Isolated Chloroplasts (1939)
Hill R, Scarisbrick R Production of Oxygen by Illuminated Chloroplasts (1940)
Niel CB On the morphology and physiology of the purple and green sulphur bacteria (1932)
Le rôle des chloroplastes dans la photosynthèse et dans la production d’oxygène fut établi par le médecin – et musicien ! – Theodor W. Engelmann au cours d’une série d’expériences sur des algues vertes filamenteuses. Spirogyra forme des filaments de plusieurs centimètres de longueur. Les cellules possèdent un volumineux noyau et des chloroplastes disposés en spirale (d’où le nom de l’algue). Chladophora est formée de cellules cylindriques de 40 à 60 micromètres de longueur, bourrées de chloroplastes réticulés. Engelmann introduisit des bactéries strictement aérobies dans une culture de Spirogyra. Il illumina les filaments avec un faisceau de lumière et observa au microscope le regroupement des bactéries autour des zones riches en chloroplastes. A l’aide d’un prisme, Engelmann illumina les filaments de Chladophora avec un faisceau de lumière bleu, jaune ou rouge. Les bactéries aérobies se regroupaient autour des zones illuminées par de la lumière rouge ou bleue.
Références : Engelmann TW Neue Methode zur Untersuchung der Sauerstoffausscheidung pflanzlicher und thierischer Organismen (1881)
Engelmann TW Ueber Sauerstoffausscheidung von Pflanzenzellen im Microspectrum (1882)
Engelmann TW Farbe und Assimilation (1883)
Engelmann T W Untersuchungen über die quantitativen Beziehungen zwischen Absorption des Lichtes und Assimilation in Pflanzenzellen (1884)
Note : Engelmann était un grand amateur de musique ; sa seconde épouse était une pianiste confirmée. Il fut l’ami du compositeur Johannes Brahms, qui lui dédia le quartet opus 67, dans son arrangement pour piano à quatre mains.
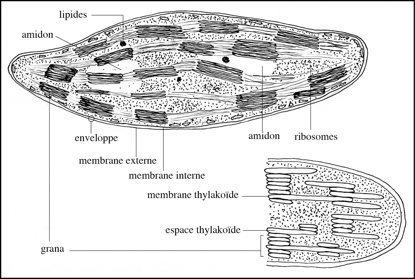
Les chloroplastes appartiennent à la vaste famille des « plastides ». Au milieu des années 1880, les botanistes Arthur Meyer (Philipps-Universität Marburg), Hugo von Mohl (Eberhard Karls Universität) et Andreas F.W. Schimper (Rheinische Friedrich-Wilhelms-Universität, Bonn) observèrent au microscope optique des des grains de chlorophylle – « Chlorophyllkörnen » – au sein d’un stroma amorphe. Meyer découvrit que la chlorophylle est contenue dans des structures, qu’il baptisa du nom d’autoplastes (granas). En 1847, Eduard Strasburger (Rheinische Friedrich-Wilhelms-Universität, Bonn) remplaça l’appellation « Chlorophyllkörnen » par le terme « chloroplastes ». En 1936, E. Heitz (Hamburg) montra que ce n’étaient pas des grains mais des disques. L’examen au microscope électronique révéla que les chloroplastes sont entourés d’une double membrane : une membrane externe et une membrane interne, entourant le stroma, au sein duquel les replis d’une troisième membrane, la membrane thylakoïde, forment les empilements de disques appelés grana. Les chloroplastes existent chez les plantes, les algues et les cyanobactéries.
Références : Meyer A Das Chlorophyllkorn in chemischer, morphologischer und biologischer Beziehung (1883)
Schimper AFW Über die Entwicklung der Chlorophyllkörner und Farbkörper (1883)
Schimper AFW Untersuchungen über die Chlorophyllkörper und die ihnen homologen Gebilde (1885)
Heitz E Untersuchungen über den Bau der Plastiden. 1. Die gerichteten Chlorophyllscheiben der Chloroplasten (1936)
La préparation par centrifugation de chloroplastes, sans contamination excessive par des mitochondries, ne semblait pas, de prime abord, poser de problèmes particuliers : les chloroplastes sont des organites abondants (quelques dizaines à quelques centaines par cellule) et de grande taille (les plus volumineux après le noyau). A la fin des années 1930, Robert Hill (Department of Biochemistry, Cambridge University) prépara un homogénat de feuilles dans une solution de saccharose 280 millimolaire, ce qui correspond à une pression osmotique voisine de celle du cytoplasme des cellules du mésophylle (tissu riche en chloroplastes situé sous l’épiderme des feuilles). Les organites qu’il isola par centrifugation étaient inactifs : ni photo-respiration ni fixation de carbone in vitro. Les chloroplastes sont des organites fragiles ; l’enveloppe à double membrane est facilement endommagée au cours de l’homogénéisation des tissus, avec perte partielle de stroma et de cations, dont le magnésium. De plus, certains tissus végétaux sont riches en tanins, des composés polyphénoliques qui se fixent sur les enzymes des plastides et les rendent inactifs. Il convenait donc de trouver un tissu végétal pauvre en tanins, facile à broyer et de définir la composition d’un milieu d’homogénéisation préservant les activités métaboliques des chloroplastes. Les premières préparations de chloroplastes ayant conservé la capacité de fixer du CO2 in vitro furent obtenues par Daniel I. Arnon (University of California, Berkeley). D. A. Walker (Department of Botany, The University, Sheffield) codifia le processus de purification, étape par étape : broyage, homogénéisation, centrifugation ; plutôt que d’utiliser comme matériel expérimental des tissus rigides, difficiles à broyer au mortier ou au broyeur à lames (Waring Blendor), il porta son choix sur des tissus riches en mésophylle : feuilles d’épinard (Spinacia oleracea) ou de pois (Pisum sativum). Le milieu d’homogénéisation (pH 8,0) fut additionné de solutés ne franchissant pas la membrane chloroplastique : saccharose, sorbitol, mannitol ; et de magnésium (présent dans les chlorophylles). Le contrôle de qualité des préparations de chloroplastes au microscope à contraste de phase permet de différencier les organites intacts de ceux dont la double membrane a été endommagée par le broyage ; les organites intacts apparaissent sous forme de cylindres réfringents ; les chloroplastes endommagés, moins denses, sont éliminés par centrifugation en gradient de densité. L’utilisation, comme matériel expérimental, de protoplastes permet d’éviter les inconvénients du broyage des tissus ; ces cellules végétales ont conservé leur membrane plasmique mais sont débarrassées de leur paroi pecto-cellulosique rigide.
Références : Arnon DI, Allen MB, Whatley FR Photosynthesis by Isolated Chloroplasts (1954)
Arnon DI, Allen MB, Whatley FR Photosynthesis by isolated chloroplasts. IV. General concept and comparison of three photochemical reactions (1956)
Whatley FR, Allen MB, Rosenberg L, Capindale JB, Arnon DI Photosynthesis by isolated chloroplasts. V. Phosphorylation and carbon dioxide fixation by broken chloroplasts (1956)
Allen MB, Whatley FR, Arnon DI Photosynthesis by isolated chloroplasts: VI. Rates of conversion of light into chemical energy in photosynthetic phosphorylation (1958)
Walker DA, Hill R The relation of oxygen evolution to carbon assimilation with isolated chloroplasts (1967)
Chlorophylles et autres pigments
Au début du XIXe siècle, les pharmaciens Pierre J. Pelletier et Joseph B. Caventou recherchaient des alcaloïdes d’origine végétales douées de propriétés pharmacologiques ; leurs noms sont restés attachés à la découverte de la quinine, en 1820 ; ils isolèrent d’autres alcaloïdes, parmi lesquels l’émétine, la brucine et la strychnine. La purification de ces substances à partir d’extraits de feuilles était rendue laborieuse par la présence d’énormes quantités d’un pigment vert qu’ils baptisèrent, en 1818, « chlorophylle » par référence à sa couleur et à sa présence dans les feuilles. La chlorophylle fut isolée en 1913 par Richard M. Willstäter (Polytechnikum, Zürich), qui reçut en 1920, après la Première Guerre mondiale, le prix Nobel de chimie qui lui avait été attribué en 1915. La formule de la chlorophylle fut établie par Hans Fischer (prix Nobel de chimie 1930) : la chlorophylle est un dérivé de l’hème, avec un noyau tétrapyrrolique contenant un atome de magnésium, de nombreuses doubles liaisons conjuguées (qui jouent un rôle essentiel dans l’interaction avec les photons et leur capture) et un alcool à longue chaîne hydrocarbonée, le phytol, dont l’hydrophobicité permet l’ancrage dans les membranes. Il existe une variété de chlorophylles différant entre elles par leurs chaînes latérales et leurs propriétés spectrales ; leur couleur dominante est le vert. En 1906, le botaniste Mikhail S. Tsvett (Laboratoire de biologie, Académie russe des sciences) sépara, par chromatographie d’adsorption sur une colonne de carbonate de calcium, une chlorophylle bleue (α ou a) d’une chlorophylle jaune (β ou b). Leur rôle dans la photosynthèse fut découvert par René Joachim Henri Dutrochet. Leur implication dans la transformation d’énergie lumineuse en énergie chimique fut mise en évidence par le botaniste Julius von Sachs. La chlorophylle a est présente chez tous les végétaux qu’ils soient terrestres ou aquatiques (plancton). La chlorophylle b est présente chez les végétaux supérieurs et les algues vertes. Les chlorophylles a et b ont des spectres d’absorption entre 400 et 700 nm légèrement différents. La chlorophylle a présente deux pics d’absorption à 430 et 660 nm ; la chlorophylle b à 445 et 645 nm. Elle absorbe mieux la lumière à 445 nm que la chlorophylle a à cause d’une légère différence de formule chimique : le remplacement d’un groupe méthyle par un groupe formyle. Les bactéries phototrophes anoxygéniques, découvertes par Cornelis B. van Niel, renferment des bactériochlorophylles de structures voisines de celles des chlorophylles.
Références : Pelletier C Sur la matière verte des feuilles (1817)
Pelletier C Sur la matière verte des feuilles (1818)
Pelletier C Des recherches chimique sur les Quinquinas (1820)
Willstäter R, Utzinger M Untersuchungen über Chlorophyll. über die ersten Umwandlungen des Chlorophylls (1911)
Willstäter R, Forsén L Untersuchungen über Chlorophyll. XXI. Einführung des Magnesiums in die Derivate des Chlorophylls (1913)
Tswett M Physikalisch-chemische Studien über das Chlorophyll. Die Adsorptionen (1906)
Tswett M Adsorptionsanalyse und chromatographische Methode. Anwendung auf die Chemie des Chlorophylls (1906)
Dutrochet RJH Mémoires pour servir à l’histoire anatomique et physiologique des végétaux et des animaux (1837)
van Niel CB On the morphology and physiology of the purple and green sulphur bacteria (1931)
A 680 nm, le pigment le plus actif de la photosynthèse est la chlorophylle a ; à 650 nm, c’est la chlorophylle b ; aux courtes λ (430 – 440 nm), les chlorophylles a et b interviennent avec une égale efficacité. Chez les bactéries phototrophes anoxygéniques (bactéries pourpres), les bactériochlorophylles a et b présentent un pic d’absorption spectrale au-dessus de 800 nm. Parmi les pigments « accessoires » présents chez les organismes photosynthétiques, on trouve les α, β et γ-carotènes de couleur jaune, rouge ou orangé, qui absorbent la lumière verte (400 à 500 nm). Les carotènes sont de longues molécules linéaires avec une alternance de simples et de doubles liaisons (polyènes). La famille des caroténoïdes comprend encore les xanthophylles (lutéine) et les phycobilines (phycoérythrobiline, phycocyanobiline), présentes chez les cyanobactéries et les algues rouges (Rhodophyta). Elles absorbent les lumières rouge, orange, bleu, ou violette, selon leur nature. Associées à des protéines, les phycobilines forment des phycobiliprotéines : phycoérythrine et phycocyanine absorbant les lumières orange et rouge, (pics à 600 nm et vers 620 nm, respectivement) et qui s’assemblent en complexes supramoléculaires collecteurs de photons appelés phycobilisomes. Avec une lumière variant de 800 à 400 nm, les quantités d’énergie que les divers pigments peuvent absorber sont considérables (36 à 72 kilocalories par molécule-gramme) comparées à celle consommée ou libérée par les réactions biochimiques (ΔG). Chez la bactérie pourpre Halobacterium halobium, une Archébactérie vivant dans les saumures, le centre réactionnel utilise, pour capter les photons, un carotène au lieu de bactériochlorophylle. En plus d’élargir le spectre de la lumière absorbée en couvrant pratiquement tout le spectre de la lumière visible, les pigments accessoires jouent un rôle protecteur (propriétés antioxydantes des caroténoïdes). Chez la diatomée Nitzschia closterium, Herbert J. Dutton et Winston M. Manning montrèrent, en 1941, que la fucoxanthine et les caroténoïdes interviennent dans la réduction du CO2 ; Robert Emerson et Charlton M. Lewis (The Carnegie Institution of Washington, Division of Plant Biology, Stanford University) ont montré que c’est également le cas pour la phycocyanine chez l’algue bleu vert Chroöcoccus, pour les phycobilines bleue et rouge chez certaines algues, et pour le fucoxanthol chez les algues brunes et les diatomées.
Références : Dutton HJ, Manning WM Evidence for Carotenoid-Sensitized Photosynthesis in the Diatom Nitzschia closterium (1941)
Emerson R, Lewis CM The Photosynthetic Efficiency of Phycocyanin in Chroococcus, and the Problem of Carotenoïd Participation in Photosynthesis (1942)
Bactéries phototrophes
Étant donné la multiplicité des termes utilisés, un peu de sémantique s’impose. Les bactéries phototrophes sont autotrophes ; elles synthétisent leurs constituants organiques en réduisant CO2 et de la matière organique. Ce sont des bactéries photosynthétiques : leurs pigments leur permettent d’utiliser l’énergie des photons solaires. Les bactéries chimiotrophes sont aussi autotrophes : elles synthétisent leurs constituants organiques en tirant de l’énergie de composés chimiques. A l’exception des végétaux chlorophylliens et des bactéries chimiotrophes, les espèces vivantes sont toutes hétérotrophes. Elles se nourrissent en consommant les matières organiques élaborées par les organismes autotrophes. Les bactéries phototrophes vivent le plus souvent en milieu aquatique, dans les eaux douces ou marines. On distingue les bactéries phototrophes selon la nature du pigment dominant : bactériochlorophylle chez les bactéries vertes, et caroténoïdes (spirilloxanthine, sphéroïdène, sphéroïdénone) chez les bactéries pourpres. On distingue aussi les bactéries phototrophes selon la nature du substrat fournissant les électrons : les bactéries pourpres sulfureuses (Chromatiaceae) tirent leurs électrons de composés soufrés : hydrogène sulfureux (H2S), sulfure, soufre ou thiosulfate ; elles sont anaérobies ; les bactéries pourpres non-sulfureuses (Rhodospirillaceae) tirent leurs électrons de substrats organiques : lactate ou acétate ; elles sont aérobies.
Les Cyanobactéries (algues bleu vert) forment un phylum à part ; elles tirent leurs électrons d’H2O, comme les plantes eucaryotes et les algues ; leur photosynthèse est oxygénique, tandis que chez les bactéries vertes ou pourpres, sulfureuses ou non-sulfureuses, la photosynthèse est anoxygénique (sans libération d’oxygène). Pieter A. Roelofsen (Utrecht Universiteit) montra, en 1934, que la bactérie pourpre non sulfureuse Thiorhodacea produit de l’H2, qui fixe le CO2 dans des composés organiques. En aérobie, lorsque les algues vertes sont éclairées, elles produisent de l’O2 (photosynthèse oxygénique). En 1942, Hans Gaffron (Institute of Molecular Biophysics, Florida State University), un élève d’Otto Warburg au Kaiser Whilhelm Institute für Biologie à Berlin, découvrit qu’en anaérobie, l’algue verte Scenedesmus obliquus utilise H2 pour réduire le CO2 (pendant la phase sombre) et que lorsqu’elle est éclairée, elle libère de l’H2. H2 est une source d’électrons :
Dans les années 1970, il montra qu’une hydrogénase est liée à l’appareil photosynthétique de ces algues ce qui leur permet d’utiliser l’énergie des photoélectrons pour produire de l’H2 (flux d’électrons non-cyclique impliquant l’hydrogénase et le photosystème I). Gaffron appela ce phénomène « photoréduction par l’hydrogène », « photosynthèse anaérobie » et, finalement, « photoréduction ». En aérobie, l’algue cesse d’utiliser l’H2 ; l’O2 est un puissant inhibiteur du métabolisme de l’H2 en supprimant l’expression de l’hydrogènase.
Références : Roelofsen PA On Photosynthesis of the Thiorhodaceae (1935)
Gaffron H Reduction of CO2 with H2 in green plants (1939)
Gaffron H Carbon dioxide reduction with molecular hydrogen in green algae (1940)
Gaffron H Reduction of carbon dioxide coupled with the oxyhydrogen reaction in algae (1942)
Gaffron H and Rubin J Fermentative and photochemical production of hydrogen in algae (1942)
Kaltwasser H, Stuart TS, Gaffron H Light-Dependent Hydrogen Evolution by Scenedesmus (1969)
C’est l’étude des bactéries sulfureuses vertes et pourpres qui permit au microbiologiste Cornelius B. van Niel (Hopkins Marine Station, Stanford University) de conclure, en 1931, que la photosynthèse est une réaction d’oxydo-réduction dépendante de l’énergie des photons. L’oxydation d’un composé (par exemple H2S) libère de l’H2 qui réduit le CO2 en hydrates de carbone, selon les réactions :
Van Niel émit l’hypothèse que chez les plantes le donneur d’H2 est H2O, et que l’O2 libéré ne provient pas de CO2 mais d’H2O.
L’appareil photosynthétique des bactéries phototrophes a fait l’objet de multiples études ; c’est une version simplifiée de celui des algues et des plantes supérieures. Les bactéries pourpres et les bactéries vertes utilisent un photosystème de type PSI (voir sous-chapitre « Photosystèmes »). Elles n’ont pas de photosystème de type PSII et ne produisent pas d’oxygène. La comparaison des structures tridimensionnelles de centres réactionnels purifiés et cristallisés, et les analyses phylogénétiques ont montré que les centres ont tous une origine commune. Chez les bactéries phototrophes, l’appareil photosynthétique est inséré dans des invaginations de la membrane plasmique en forme de saccules (chromatophores). La plupart de ces bactéries possèdent deux types d’antennes collectrices de lumière : LH1, fortement liée au centre réactionnel auquel elle transmet directement des excitons, et LH2, qui transmet l’énergie d’excitation au centre réactionnel via LH1. Ces complexes renferment de la bactériochlorophylle a (parfois b) absorbant la lumière entre 850 et 900 nm, et des caroténoïdes jaunes et rouges absorbant la lumière entre 440 et 560 nm. Le centre réactionnel P870 renferme de la bactériochlorophylle a (pic d’absorption de la lumière à 870 nm). Des transporteurs solubles d’électrons, situés dans le périplasme, et des complexes protéiques assurent une phosphorylation couplée à un transport d’électrons.
L’appareil photosynthétique
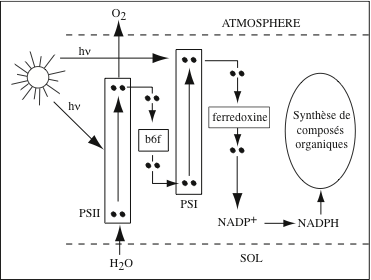
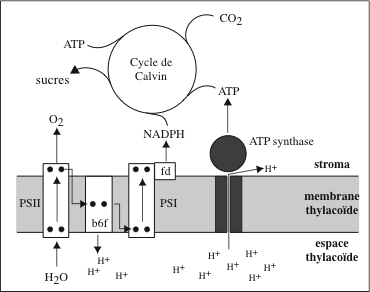
La conversion de l’énergie des photons solaires en énergie chimique se déroulent au sein des photosystèmes, des super-complexes protéiques et pigmentaires. Chez les cyanobactéries, les plantes et les algues, ils sont localisés dans les membranes thylakoïdes des chloroplastes ; chez les bactéries phototrophes, ils sont insérés dans la membrane plasmique. Ils captent les photons irradiés en abondance par le soleil et utilisent leur énergie (52 kcal/mol de photons) pour produire des photo-électrons à haut potentiel énergétique. L’énergie des photons, convertie en travail chimique, permet à des complexes protéiques d’élaborer des substances organiques à partir de substances minérales simples : C du CO2, N des NO3–, S des SO4 2-. Selon qu’il y a, ou non, libération d’O2, on distingue : la photosynthèse oxygénique, chez les plantes, les algues et les cyanobactéries ; et la photosynthèse anoxygénique, chez les bactéries vertes et pourpres. La conclusion des expériences conduites par Robert Emerson (Kerckhoff Laboratories of Biology, Califormia Institute of Technology, Pasadena), dans les années 1930, suggérait l’existence de deux photosystèmes : le photosystème I (PSI), des bactéries vertes et pourpres ; et le photosystème II (PSII) qui, chez les plantes vertes, fonctionne en série avec PSI. Le cœur de l’appareil photosynthétique est le « centre réactionnel » photosynthétique. Son alimentation en photons est assurée par deux « antennes » ; une antenne interne étroitement associée au centre réactionnel, et un complexe antennaire externe (Light Harvesting Complex, LHC) qui fournit l’essentiel des photons. Enfin, le centre réactionnel est associé à une chaîne de transfert d’électrons et à une ATP synthase.
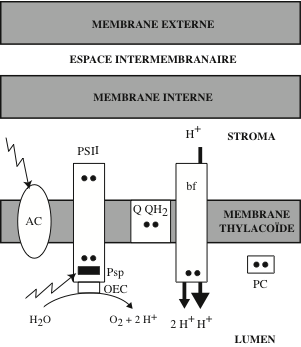
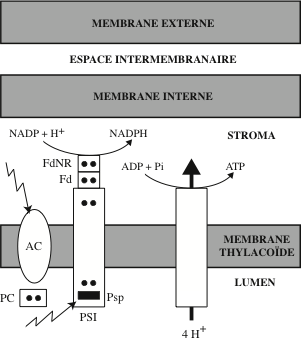
La chaîne de transport d’électrons de la membrane des thylakoïdes est analogue à celle de la membrane interne des mitochondries. Elle est alimentée par les électrons à haute énergie (1e– / 2 photons captés) fournis par la chlorophylle P680 du centre réactionnel de PSII. Les électrons sont délivrés au complexe des cytochromes b6f, un dimère inséré dans la membrane par des hélices α. Sa structure cristallographique a été élucidée chez l’algue verte Chlamydomonas reinhardtii, et chez les Cyanobactérie Mastigocladus laminosus et Nostoc. b6f est une oxydoréductase-pompe à protons qui catalyse une réaction d’échange entre le plastoquinol (QH2) et la plastocyanine (PC), un transporteur soluble qui transfère les électrons de PSII à PSI :
Le complexe b6f utilise l’énergie des électrons pour pomper 2 H+ dans l’espace luminal thylakoïde. Les électrons ayant perdu une partie de leur énergie sont réactivés par la chlorophylle a P700 du centre réactionnel de PSI. Ils sont délivrés à une protéine à Fe-S, la ferrédoxine, puis la ferrédoxine-NADP+ réductase, localisées sur la face stromale de la membrane thylakoïde. Cette oxydo réductase catalyse la réaction :
L’appellation des chlorophylles de la paire spéciale, « P700 » et « P680 », fait référence à leur pic d’absorption dans le rouge. Il s’agit dans les deux cas de chlorophylle a mais leur environnement protéique et pigmentaire fait que ces pics sont légèrement différents : 680 nm pour les chlorophylles de PSII et 700 nm pour celles de PSI. Le NADPH produit est consommé dans le cycle de Calvin, qui se déroule dans le stroma des chloroplastes. Le trajet des électrons dans les photosystèmes et les chaînes de transfert d’électrons de la membrane thylakoïde a été reconstitué par Fay Bendall et Robert Hill (Department of Biochemistry, University of Cambridge) sous forme d’un schéma réactionnel appelé « Z scheme », par référence à la forme prise par les couples redox disposées sur une échelle de potentiels. La première barre verticale du Z correspond au saut de potentiel de P680 à P680* ; la seconde barre verticale, au saut de potentiel de P700 à P700* ; P680* et P700 sont réunies entre elles par la séquence des transporteurs d’électrons, de la phéophytine à la plastocyanine, disposée selon une barre oblique. Pour la production d’ATP, chloroplastes et mitochondries utilisent des stratégies semblables : le pompage de protons à travers une membrane en utilisant l’énergie libérée au cours des transferts d’électrons. La différence de pH entre le lumen (+/- 4,0) et le stroma (+/- 8,0) et de potentiel électrique crée un potentiel électrochimique transmembranaire.
Références : Emerson R, Arnold W A separation of the reactions in photosynthesis by means of intermittent light (1932)
Emerson R, Arnold W The photochemical reaction in photosynthesis (1932)
Kurisu G, Zhang H, Smith JL, Cramer WA Structure of the Cytochrome b6f Complex of Oxygenic Photosynthesis: Tuning the Cavity (2003)
Yamashita E, Zhang H, Cramer WA Structure of the cytochrome b6f complex: quinone analogue inhibitors as ligands of heme cn (2007)
Hill R, Bendall F Function of the two cytochrome components of chloroplast: a working hypothesis (1960)
Note : Henri Taube (Cornell University, Ithaca), prix Nobel de Chimie 1983, fut un pionnier de l’étude des transferts d’électrons entre complexes métalliques.
En 1971, Lien et Ephraïm Racker avaient observé que la face stromale de la membrane thylakoïde est hérissée de particules de 9 nm de diamètre qui, par leur forme et leur taille, rappelaient les particules décrites par Humberto Fernandez-Moran dans la membrane mitochondriale interne, et qui sont de l’ATP-synthase. Ce complexe utilise le potentiel électrochimique transmembranaire pour synthétiser 2,6 molécules d’ATP en consommant 12 H+. Un einstein de lumière visible (6*1023 photons) fournit une énergie de ± 230 kilojoules ; la synthèse d’une molécule d’ATP à partir d’ADP et de Pi consomme ± 40 kilojoules. En 1966, André T. Jagendorf (Section of Plant Biology, Cornell University) transposa aux chloroplastes l’hypothèse chimio-osmotique formulée par Peter Mitchell pour expliquer le mécanisme de synthèse de l’ATP dans les mitochondries. Il conçut, avec Ernest G. Uribe, une expérience d’une lumineuse simplicité. Ils chargèrent en H+ des chloroplastes de feuille d’épinard en les incubant à l’obscurité dans une solution de pH acide. Les protons franchirent la membrane thylakoïde par diffusion passive et s’accumulèrent dans les disques. Les chloroplastes, placés à l’obscurité, dans une solution de pH plus élevé, en présence d’ADP et de Pi synthétisèrent de l’ATP. C’était la première confirmation directe de l’hypothèse de Peter Mitchell !
Références : Fernandez-Moran H New Approaches in the Study of Biological Ultrastructure by High-resolution Electron Microscopy (1962)
Uribe EG, Jagendorf AT Organic Acid Specificity for Acid-Induced ATP Synthesis by Isolated Chloroplasts (1967)
Mitchell PD Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism (1961)
Les complexes antennaires externes (LHC) dirigent les photons solaires vers les chlorophylles de la paire spéciale du centre réactionnel. Ces chlorophylles captent aussi directement des photons mais à une fréquence trop faible (un photon par seconde) pour alimenter une photosynthèse active. Le rendement en photons est accru par l’antenne interne des centres réactionnels P680 et P700, composées de caroténoïdes, chlorophylles b, et chlorophylles a. Les complexes collecteurs externes (LHC) sont les principaux fournisseurs de photons des centres réactionnels ; LHC1 est associé au photosystème I ; LHCII s’associe aux photosystèmes II ou I en fonction des conditions d’éclairement. Ils sont formés de protéines, de cofacteurs et de pigments ; ils sont orientables et dotés d’une certaine mobilité. Ils sont synthétisés en fonction des conditions lumineuses. La structure du LHCII des chloroplastes de feuilles d’épinard a été établie par Xuepeng Wei et coll. (National Laboratory of Biomacromolecules, Institute of Biophysics, Chinese Academy of Sciences, Beijing). C’est un homo-dimère dont chaque monomère est composé de 25 sous-unités protéiques, 105 chlorophylles b, 28 caroténoïdes et de cofacteurs. Dans les antennes, l’énergie des photons captés circule de chlorophylle en chlorophylle, sans perte d’énergie, par transfert d’énergie de résonance ; pour atteindre sa destination finale, une chlorophylle de la paire spéciale, elle transite par une chlorophylle servant de pont entre l’antenne et le centre réactionnel.
Référence : Xuepeng W, Xiaodong S, Peng C, Xiuying L, Wenrui C, Mei L, Xinzheng Z, Zhenfeng L Structure of spinach photosystem II-LHC II supercomplex at 3,2 Å resolution (2016)
Découverts au début du XXe siècle, les phycobilisomes sont des complexes collecteurs de photons de grande taille (16.800.000 daltons chez l’algue rouge photosynthétique Griffithsia pacifica) ; au-delà d’un mètre sous la surface des mers et des océans, la quantité de lumière est limitée ; pour compenser ce manque d’éclairement, les algues sont dotées d’antennes d’une grande efficacité : les phycobilisomes. Ils sont présents dans les membranes photosynthétiques des algues marines rouges (Rhodophyta), des cyanobactéries et des algues d’eau douce Glaucocystophyta. Ils ont été isolés dans les années 1960 par Elisabeth Gantt et Stephen F. Conti (Radiation Biology Laboratory, Smithsonian Institution, Washington) et étudiés par Alexander N. Glazer (Division of Biochemistry, Biophysics and Structural Biology, University of California, Berkeley). Rita Khanna, dans le laboratoire d’Elisabeth Gantt, montra que les phycobilisomes sont associées au Photosystème II.
Références : Gantt E, Conti S Phycobiliprotein localization in algae (1966)
Gantt E, Lipschultz CA, Zilinskas B Further evidence for a phycobilisome model from selective dissociation, fluorescence emission, immunoprecipitation, and electron microscopy (1976)
Glazer AN, Fang S Chromophore Content of Blue-Green Algal Phycobiliproteins (1973)
Lundell DJ, Williams RC, Glazer AN Molecular Architecture of a Light-harvesting Antenna. In Vitro Assembly of the Rod Substructures of Synechococcus6301 Phycobilisomes (1981)
Khanna R, Graham JR, Myers J, Gantt E Phycobilisome composition and possible relationship to reaction centers (1983)
En 2017, Jun Zhang et coll. (State Key Laboratory of Membrane Biology, Beijing Advanced Innovation Center for Structural Biology) élucida la structure du phycobilisome d’une algue rouge par cryo-microscopie électronique à la résolution de 3.5 Å. Ces auteurs ont recensé la présence de 862 protéines et de 2.048 pigments, des phycobilines : phycoérythrobiline (rouge), phycocyanobiline (bleue), phyco urobiline (orange), phycobilivioline (absorbant la lumière violette). Elles sont liées par une liaison thio-éther à des protéines nommées biliprotéines : phycoérythrine, phycocyanine, allophycocyanine. Les phycobiliprotéines ainsi formées sont des hexamères α3 β3 qui s’assemblent en complexes supramoléculaires. Leur architecture consiste en alignements tubulaires de phycoérythrine greffés, via une phycocyanine, sur un noyau central d’allophycocyanine. Cet agencement, qui rayonne à partir du centre, assure une grande surface de capture des photons, avec un rendement optimal de 95%. Nicole Tandeau de Marsac et Germaine Cohen-Bazire (Unité de Physiologie microbienne, Institut Pasteur, Paris) ont montré que les phycobilisomes contiennent aussi des protéines non liées à des pigments. Ces protéines sont parties prenantes de l’architecture du complexe qui repose sur la membrane au-dessus du photosystème PSII. L’énergie des photons captés est transmise, via un pigment terminal, à la chlorophylle du centre réactionnel en moins de 100 ps (10-10s).
Références : Jun Z, Jianfei M, Desheng L, Song Q, Shan S, Jindong Z, Sen-Fang S Structure of phycobilisome from the red alga Griffithsia pacifica (2017)
de Marsac NT, Cohen-Bazire G Molecular composition of cyanobacterial phycobilisomes (1977)
Dans les centres collecteurs de photons, les pigments sont alignés côte à côte et répartis en anneaux concentriques dans les hélices α des protéines antennaires. Les molécules de chlorophylle voisines sont séparées par une distance de 0,22 nm, une disposition hautement favorable à la transmission d’énergie de résonnance entre elles. En 1932, le physicien Francis Perrin (Collège de France) publia un article intitulé « Théorie quantique des transferts d’activation entre molécules de même espèce ». Si l’énergie (hν) d’un photon capté par un chromophore est du même ordre de grandeur que la différence des niveaux d’énergie de ce chromophore :
le photon est absorbé et il se produit, en un laps de temps de 10-15 seconde, un « saut » d’électron de son orbitale à une orbitale d’énergie plus élevée. Si le chromophore est une chlorophylle, celle-ci passe de l’état fondamental à l’état excité :
La chlorophylle peut adopter quatre états d’excitation[2] . Aux deux premiers états d’excitation, le retour de l’électron sur son orbitale initiale (en moins d’une nanoseconde) s’accompagne d’une libération d’énergie. Le terme « exciton » a été créé en 1931, par le physicien Yakov I. Frenkel (Institut physico-technique de Léningrad) ; dans la photosynthèse il désigne l’énergie excitée libérée. L’énergie de résonnance est l’énergie gagnée par un système qui délocalise ses électrons ; elle peut circuler de molécule à molécule. Ce phénomène fut théorisé en 1948 par le physicochimiste Theodor Förster (Max Planck Institute for Physics, Göttingen). Le transfert d’énergie par résonnance Förster (Förster Resonance Energy Transfer, FRET) est possible entre molécule donneuse d’énergie et molécule réceptrice séparée par une distance inférieure à 10 nm. L’électron délocalisé ne quitte Chl* que s’il trouve un accepteur à la distance requise (rayon de Förster) :
Le cœur du photosystème est le centre réactionnel photosynthétique. Le concept d’« unité photosynthétique » fut introduit par Robert Emerson et William Arnold (William Kerckhoff Laboratories of the Biological Sciences, California Institute of Technology). Chlorella est une algue verte unicellulaire, appartenant au phylum des Chlorophytes, avec des cellules sphériques (diamètre 2 à 10 μm) renfermant des chloroplastes. Otto H. Warburg (Kaiser Whilhelm Institute für Biologie, Berlin) avait mis au point une méthode manométrique pour évaluer l’activité photosynthétique de suspensions de Chlorella pyrenoidosa en mesurant la quantité de CO2 réduit. En 1923, Warburg et Erwin Negelein avaient calculé que la réduction d’une molécule de CO2 nécessite l’absorption de 4 photons, ce qui faisait de la photosynthèse un processus d’une grande efficacité, avec un rendement de 30% pour convertir l’énergie des photons en énergie chimique. Adoptant cette méthodologie, Emerson et William Arnold illuminèrent une suspension de Chlorella avec une série d’éclairs très brefs (10-5 s) suivis d’une pause ; dans ces conditions, la machinerie photosynthétique, excitée une seule fois par éclair, produit une molécule d’O2 (pendant la phase claire) ou réduit une molécule de CO2 (phase sombre). L’intervalle entre deux éclairs variait de 1 à 40 millisecondes. La courbe représentant le nombre de molécules d’O2 libérées par flash atteint un plateau. Emerson et Arnold établirent le rapport entre la quantité de molécules de chlorophylle présente dans les algues et la quantité de molécules d’O2 libérées. C’était une façon de calculer ce que l’on n’appelait pas encore le rendement quantique de la photosynthèse. Le maximum de rendement par flash était atteint quand une molécule de chlorophylle sur 2.480 absorbait un quantum. Emerson calcula aussi que les réactions enzymatiques de la phase sombre se déroulent en 10 ms. Dans l’article « A separation of the reactions in photosynthesis by means of intermittent light » Emerson et Arnold avançaient l’hypothèse: « there are units in the photosynthetic mechanisms ». En 1936, Hans Gaffron et K. Wohl (Institute of Molecular Biophysics, Florida State University) donnèrent une interprétation des résultats d’Emerson ; les molécules de chlorophylles excédentaires assureraient le transfert de l’énergie d’excitation vers un « photoenzyme ». C’était une ébauche des concepts d’antennes et de centre réactionnel. En 1939, Emerson et Arnold démontrèrent que la libération d’une molécule d’O2 selon la réaction :
ou la réduction d’une molécule de CO2 :
nécessitent la captation de 8 à 12 photons, et non pas 4 comme l’avaient prétendu Otto Warburg et Erwin Negelein en 1923 (le nombre exact est 8 quantas).
En 1957, Emerson avait observé que le rendement quantique à 700 nm est faible bien que la chlorophylle absorbe la lumière rouge. Il appela cette anomalie « Red drop ». Le rendement quantique de suspensions de chloroplastes illuminées simultanément par deux faisceaux lumineux à 653 nm et 700 nm est plus élevé que la somme des rendements des suspensions éclairées séparément à chacune de ces longueurs d’onde. L’existence de ce phénomène, appelé « Effet Emerson » (Emerson enhancement effect), était une confirmation de l’existence de deux Photosynthetic Units renfermant chacune environ 300 chlorophylles (2 500 / 8). Lorsque les chloroplastes sont illuminés par un seul faisceau, il se produirait une saturation des pigments d’un photosystème par excès de quantas. Le rendement quantique augmente lorsqu’on active le second photosystème en illuminant les chloroplastes avec un second faisceau de longueur d’onde moins élevée.
La thèse de doctorat présentée en 1952 par Louis N.M. Duysen (Leiden Universiteit) s’intitulait : « Transfer of Excitation Energy in Photosynthesis ». L’idée était d’appliquer la théorie du physico-chimiste Theodor Förster au transfert d’énergie de résonance entre pigments accessoires ayant capté des photons. Duysen observa, par spectrophotométrie d’absorption, les changements survenant dans les membranes photosynthétiques d’une bactérie, Rhodospirillum rubrum après illumination par un flash de lumière rouge (λ = 870 nm). Il nota une diminution temporaire d’absorption de la lumière. Ce blanchiment (bleaching) révélait l’existence d’un pigment P, à faible concentration, captant l’énergie d’excitation au cœur du centre réactionnel. Bessel Kok (Laboratory for Plant Physiologie Agricultural University, Wageningen, The Netherlands) et Horst T. Witt (Max-Volmer Laboratory for Biophysical Chemistry, Technische Hochschule, Berlin) firent des observations similaires sur des chloroplastes isolés, éclairés par des éclairs lumineux de λ = 680 et 700 nm. Le blanchiment était aussi observé par addition d’un accepteur d’électrons, révélant ainsi l’existence de phénomènes d’oxydo-réduction dans le centre réactionnel. Duysens adapta sa technique à l’étude de l’appareil photosynthétique de l’algue rouge Porphyridium cruentum éclairée par une lumière rouge (680 nm) absorbée par la chlorophylle. Il évalua l’activité photosynthétique en mesurant la fluorescence de la chlorophylle. En éclairant avec un second faisceau de lumière verte (562 nm) absorbée par la phycoérythrine, il y a réduction d’un cytochrome. Cette réduction est inhibée par addition d’un herbicide (DCMU) mais pas l’oxydation du cytochrome à 680 nm. Nous savons depuis que le DCMU est un inhibiteur du photosystème II. En 1961, Louis Duysens, Jan Amesz et B.M. Kamp publièrent dans Nature un article intitulé « Two photochemical systems in photosynthesis » ; ils introduisaient le concept de « Système 2 » (photosystème II), responsable de l’activité spectrale (fluorescence) de la chlorophylle a, de l’oxydation de l’eau en oxygène et de l’oxydation du cytochrome. Le « Système 1 » (photosystème I) oxyde le cytochrome et réduit le NADP. En 1963, Duysens et H.E. Sweers découvrirent qu’un composant, présent à faible concentration, module la fluorescence de la chlorophylle a. Ils firent l’hypothèse que ce composant est l’accepteur primaire des photoélectrons de PSII. Il s’agit de la quinone QA sous sa forme oxydée QA+.
Les tentatives de purification d’un centre réactionnel commencèrent dans les années 1960. Les protéines membranaires étant difficiles à solubiliser et à obtenir sous une forme permettant l’examen cristallographique, on a d’abord examiné les préparations obtenues par microscopie électronique combinée à l’analyse aux rayons X. Aaron Klug (prix Nobel de chimie en 1982) avait mis au point cette approche dans l’étude des protéines interagissant avec l’ADN. Les images étaient de faible résolution. Dans les années 1960, des préparations de centres bactériens furent obtenues par Louis Duysens, puis, en 1971, par Clayton et R.T. Wang (Departments of Biological Sciences and Applied Physics, Cornell University) et George Feher (University of California, San Diego) à partir de Rhodopseudomonas sphaeroides. En 1982, Hartmut Michel (Universität Würzburg) cristallisa le centre réactionnel photosynthétique de la bactérie pourpre Rhodopseudomonas viridis. En 1985, le biochimiste Johann Deisenhofer et le chimiste Robert Huber (Technische Universität München) publièrent sa structure cristallographique tridimensionnelle : « Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3A resolution ». Deisenhofer, Michel et Huber reçurent le prix Nobel de Chimie en 1988. Depuis leurs travaux, les recherches sur la structure microscopique ou cristallographique des complexes (centre réactionnel, antenne) et des super-complexes (centre réactionnel avec antennes) se sont multipliées. Étant donné l’importance des enjeux environnementaux et économiques (photosynthèse artificielle ; utilisation du carbone du CO2 comme alternative au carbone fossile ; stockage de l’énergie solaire sous forme d’H2…), ces recherches font l’objet d’une intense compétition entre institutions scientifiques, principalement aux États-Unis, en Chine et en Allemagne. Pour illustrer ce point, je cite un certain nombre d’articles[6] parus depuis le début du siècle ; je me suis contenté de donner le nom du premier auteur, son affiliation, le titre de l’article et l’année de publication. A partir de ces données, le lecteur intéressé pourra facilement accéder aux articles originaux.
Le centre réactionnel de la bactérie pourpre Rhodobacter spheroïdes est formé de trois protéines transmembranaires (L, M, et H), de deux molécules de chlorophylle a (paire spéciale), et de deux quinones, QA et QB. A propos des chlorophylles de la paire spéciale, je rappelle qu’en 1951 Roderick K. Clayton (Califormia Institute of Technology) avait montré, par spectroscopie à la température de l’hélium liquide, que les chromatophores de Rhodospirillum rubrum renferment une bactériochlorophylle b dont les propriétés étaient différentes de celles des chlorophylles antennaires. Il démontra que cette bactériochlorophylle b, excitée par absorption d’un quanta, provoque la migration d’un électron, avec l’apparition d’un trou électronique dans un semi-conducteur chlorophyllien (chlorophyll semiconductor). Le physicien George Feher (Department of Physics, University of California, San Diego) étudia les étapes initiales de la séparation de charges par spectroscopie de résonance de spin (Electron paramagnetic resonance spectroscopy, EPR spectroscopy) combinée à la spectroscopie par RMN (résonance magnétique nucléaire). La technique de la photolyse d’éclairs lumineux d’une durée inférieure à la picoseconde (ps = 10-12 s), produits par un laser, permet la captation d’un seul photon par le centre réactionnel. Dans le centre réactionnel de Rhodobacter spheroïdes, les chlorophylles de la paire spéciale sont séparées l’une de l’autre par une distance de 0,32 nm. Après captation d’un photon, la bactériochlorophylle a excitée cède un électron à haute énergie à une bactériochlorophylle accessoire puis à une phéophytine (durée d transfert : 4 ps). Le photoélectron passe de la phéophytine à la quinone liposoluble QA (durée d transfert : 200 ps) puis à l’accepteur primaire QB, faiblement lié à la face cytosolique de la membrane, (durée de transfert : 200 ms à cause des changements de conformation). Au sein de la chaîne de transporteurs de la chlorophylle a à QB-, la rapidité des échanges est la condition sine qua non d’un rendement quantique élevé pour la séparation de charges. Le potentiel redox des différents pigments et quinones de la chaîne et les énergies de réorganisation des molécules jouent aussi un rôle dans le rendement des échanges. La distance de la chlorophylle a à la quinone QB est de quelques Å, pour une épaisseur de membrane d’environ 50 Å. L’ensemble acquiert une orientation, avec un côté réducteur et un côté oxydant par rapport à la membrane. Les chlorophylles a de la paire spéciale sont situées à proximité de la face luminale de la membrane thylakoïde ; la quinone QB est situé à proximité de la face stromale.
On distingue deux types de centres réactionnels : le centre de type I des bactéries vertes sulfureuses, des héliobactéries, et du photosystème I des plantes, des algues et des cyanobactéries ; le centre réactionnel de type II des bactéries pourpres, des bactéries vertes filamenteuses, et du photosystème II des plantes, des algues et des cyanobactéries.
Photosystèmes
Le photosystème II (PSII) est un complexe de protéines et de pigments, présent chez les cyanobactéries, les algues et les plantes. Il est inséré dans la membrane lamellaire thylakoïde des chloroplastes, principalement entre les grana. Il est sensible à la lumière de λ inférieure à 680 nm. Il intervient dans la première phase de la photosynthèse (phase photochimique). PSII est apparu chez les cyanobactéries (algues bleu vert, qui prolifèrent en milieu aquatique bien qu’elles ne soient pas des algues). Il représente une évolution de l’appareil photosynthétique PSI des bactéries pourpres dans laquelle la bactériochlorophylle a été remplacée par la chlorophylle. Le centre réactionnel de PSI n’a pas la capacité d’oxyder H2O, faute de générer un oxydant suffisamment puissant lors de la séparation de charges. Le centre réactionnel de PSII catalyse la photolyse de l’eau ; le terme « photolyse », bien que couramment utilisé, est incorrect car il s’agit d’une photo-oxydation avec libération de deux électrons. H2O présente l’avantage d’être très abondant sur Terre, et le désavantage d’être un donneur faible d’électrons : son potentiel standard d’oxydoréduction est :
(exactement + 0,816 Volt). Pour en faire un donneur d’électrons efficace, l’énergie de quatre photons est nécessaire.
La photolyse de l’eau est réalisée dans les chloroplastes et les cyanobactéries par un complexe, successivement dénommé Oxygen-evolving complex, Water-splitting Complex, Water-oxidizing Complex ; il fait partie du photosystème II ; il est situé sur la face stromale de la membrane thylakoïde des chloroplastes et des cyanobactéries. Sa structure cristallographique et son architecture furent établies par les groupes de Gerard Charles Dismukes (Department of Chemistry & Chemical Biology, Rutgers University, New Jersey) « An evaluation of structural models for the photosynthetic water-oxidizing complex derived from spectroscopic and X-ray diffraction signatures » (2002); de Kristina N. Ferreira (Department of Biological Sciences, Imperial College London) « Architecture of the photosynthetic oxygen-evolving center » (2004); et de Nobuo Kamiya (Institute for Protein Research, Osaka University): « Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å » (2011). La cristallographie aux rayons X endommage certaines structures ; c’est pourquoi les informations obtenues par cette technologie durent être complétées par spectrophotométrie d’absorption des rayons X (Extended X-Ray Absorption Fine Structure) et par spectroscopie de résonance paramagnétique électronique (Electron spin resonance). Au cœur du complexe, on trouve l’agrégat organo-métallique Mn4O5Ca, constitué d’un atome de Ca2+ et de 4 atomes de Mn+ reliés par des ponts oxo (O=métal) à 5 atomes d’oxygène. Mn0 est un élément très électropositif ; sa structure électronique laisse prévoir plusieurs états d’oxydation +2, +3, +4, +6 +7 par lesquels il passe au cours des quatre réactions successives conduisant à l’oxydation de deux molécules d’eau avec extraction de quatre électrons et production de quatre ions hydrogène (protons) et une molécule d’oxygène :
Ce mécanisme en quatre étapes a été proposé par Bessel Kok et al. (Laboratory for Plant Physiologie Agricultural University, Wageningen) Cooperation of charges in photosynthetic O2 evolution-I. A linear four step mechanism (1970). Le substrat – deux molécules de H2O – est fixé à l’agrégat Mn4O5Ca ; c’est le plus puissant des oxydants biologiques connus ; il catalyse la photo-oxydation de l’eau au cours des réactions de la phase claire. Notons que la réaction ci-dessus est l’inverse de celle catalysée par l’oxydase terminale de la chaîne respiratoire mitochondriale (cytochrome oxydase) :
Les premières images du centre réactionnel de PSII furent obtenues par microscopie électronique, à une résolution de 15 à 30 Å. A partir d’un cristal bidimensionnel de Mr 600 kDa, ayant conservé la capacité de capturer les photons et de transférer des électrons à un accepteur, mais pas celle d’oxyder l’eau, le groupe de James Barber (Imperial College London) établit une structure cristallographique à une résolution de 8 Å. En 2001, Wolfram Saenger (Institut für Chemie, Kristallographie, Freie Universität Berlin) obtint la structure du photosystème II d’une cyanobactérie (Synochococcus elongatus) à la résolution de 3.8 Å. En 2009, le même groupe publia une structure plus détaillée : « Cyanobacterial photosystem II at 2.9-Å resolution and the role of quinones, lipids, channels and chloride ». PSII, ou H2O-plastoquinone oxydoréductase, est formé de deux protéines homologues, D1 et D2, ancrées dans la membrane par des hélices α. Au total, le super-complexe comprend une vingtaine de protéines différentes, des protéines antennaires, des cofacteurs, de la chlorophylle a, du β-carotène, de la phéophytine, deux plastoquinone et le complexe oxo-métallique Mn4CaO5, Cl– du centre de dissociation de l’eau. La chlorophylle P680 (pic d’activité à 680 nm) de la paire spéciale du centre réactionnel fut caractérisée en 1969, par Horst T. Witt (Technische Universität, Berlin). Dans les années 1980 et 1990, les chimistes Bridgette A. Barry et Gerald T. Babcock (Department of Chemistry, Michigan State University) montrèrent qu’après capture d’un photon, P680 cède un photoélectron à haut potentiel à une plastoquinone (Q) lipophile située sur la face stromale de la membrane thylakoïde :
QH2 est le plastoquinol. P680+ étant très oxydant, comble son trou électronique en participant à la dissociation de H2O avec libération de O2.
Le photosystème I (PSI) est le convertisseur de photons le plus efficace qui soit dans la nature ; il catalyse une réaction d’oxydoréduction entre la plastocyanine (PC), une protéine à Cu2+ de petite taille, et la ferrédoxine (Fd) :
PSI est présent dans la membrane des cyanobactéries et dans les chloroplastes des plantes et des algues.
En 1993, Horst T. Witt (Max-Volmer-Institut für Physikalische Chemie, Technische Universität Berlin) prépara des cristaux du PSI de la cyanobactérie thermophile Synechococcus elongatus. La structure tridimensionnelle fut établie en 1993 par le groupe de Norbert Kraus à la résolution de 6 Å, puis 4 Å, en 1996 (« Photosystem I at 4 Å resolution represents the first structural model of a joint photosynthetic reaction centre and core antenna system »). La structure cristallographique du centre réactionnel de la bactérie pourpre (Rhodopseudomonas sphaeroïdes) fut établie par le groupe de M.H. Stowell (Medical Research Council Laboratory of Molecular Biology, Cambridge, U.K.). La comparaison des structures montre que le centre réactionnel de PSI est très conservé, tandis que les complexes antennaires externes varient selon les organismes réalisant la photosynthèse oxygénique. PSI est un trimère. Les sous-unités de structure identique L et M sont insérées dans la membrane par cinq hélices α ; la sous-unité H est ancrée par une seule hélice α. La quatrième sous-unité est une protéine périphérique. Le super-complexe PSI-LHCI des végétaux supérieurs comprend 170 chlorophylles a et b et 30 caroténoïdes. Les photons lumineux captés par les antennes arrivent sur l’une des deux bactériochlorophylles a (P700) de la paire spéciale du centre réactionnel. P700 (pic d’absorption à 700 nm) fut identifié en 1956-1957 par Bessel Kok (Landbouwuniversiteit Wageningen). Un électron de la bactériochlorophylle a se déplace vers une chlorophylle accessoire, une phéophytine (une chlorophylle dans laquelle l’atome de Mg est remplacé par deux hydrogènes), les quinones QA et QB, L’accepteur primaire d’électrons QB est situé à la face cytosolique de la membrane. En 1971, Tetsuo Hiyama (Saitama University) a identifié ; par spectrophotométrie, dans les feuilles d’épinard et les algues bleu vert un autre accepteur primaire d’électrons : le complexe à Fe-S P430 (« A new photosynthetic pigment, P430 : its possible role as the primary electron acceptor of Photosystem I »). Chez les bactéries, le trou sur P700+ laissé par le départ d’un électron, est comblé par un électron issu de composés soufrés, comme l’hydrogène hydrogène sulfureux :
Chez les végétaux supérieurs, le trou électronique sur P700+ est comblé par un électron donné par la plastocyanine, une protéine soluble de petite taille possédant un atome de cuivre, et servant de navette mobile d’électrons entre PSII et PSI. La photosynthèse oxygénique requiert la coopération de PSII et de PSI fonctionnant en série [3]. Le quantum d’énergie fourni par un photon est insuffisant pour élever le niveau énergétique d’une paire d’électrons de l’eau jusqu’au NADP+. Il existe une importante différence de potentiel redox standard (1,17 volts) entre le couple donneur d’électrons de PSII :
et le couple redox accepteur final d’électrons de PSI :
La duplication des photosystèmes offre l’avantage de répartir le travail entre les deux super-complexes. En lumière visible (de 400 à 800 nm), les « transformateurs photoélectriques » P680 et P700 peuvent emmagasiner une quantité d’énergie atteignant, et parfois dépassant, 70 kilocalories par molécule-gramme. Lorsque les électrons venant de PSII sont passés à PSI par le transporteur mobile d’électrons, la plastocyanine), une partie de leur énergie a été consommée pour pomper des protons dans le lumen des thylakoïdes ; leur niveau énergétique est relevé par PSI[4] de façon à fournir les équivalents réduits nécessaires à la production de NADPH + H+ :
Le rôle du NADP dans les chloroplastes des feuilles vertes fut mis en évidence, en 1951, par Wolf Vishniac et Severo Ochoa (Department of Pharmacology, New York University College of Medicine). Ce coenzyme nucléotidique (d’abord appelé Triphospho Pyridine Nucléotide Phosphate) avait été découvert par Otto H. Warburg. Sa structure chimique est voisine de celle de la Nicotinamide Adénine Dinucléotide (NAD), le principal accepteur d’électrons dans les mitochondries. L’ensemble des réactions aboutissant à la production d’ATP et de NADPH se déroulent en présence d’énergie solaire ; ce sont les réactions dites « de la phase claire ».
Transport linéaire d’électrons versus Transport cyclique d’électrons
La photophosphorylation est l’un des trois modes de production de l’ATP chez les êtres vivants, les deux autres étant la phosphorylation oxydative mitochondriale et la phosphorylation au niveau du substrat (voir « Synthétiser de l’ATP » dans le chapitre « Mitochondries »). Le processus de synthèse de l’ATP chez les organismes photosynthétiques fut décrit en 1954 par Albert W. Frenkel (Department of Botany, University of Minnesota) chez la bactérie Rhodospirillum rubrum, et par Daniel I. Arnon (University of California, Berkeley) dans les feuilles d’épinard. Il porte le nom de « photophosphorylation non-cyclique » ou « transport linéaire d’électrons ». Il se déroule dans les chloroplastes chez les plantes, les algues photosynthétiques et les cyanobactéries. Il met en jeu, successivement : PSII, le cytochrome b6f, PSI et la ferrédoxine. Il débute par l’extraction de deux électrons de H2O, avec libération d’oxygène, par le complexe d’oxydation de l’eau de PSII, et aboutit à la réduction de NADP+ en NADPH par la ferrédoxine-NADP réductase et à la production d’une force proton-motrice avec génération d’ATP.
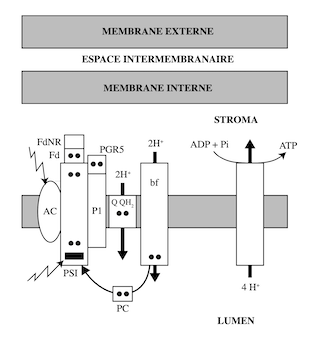
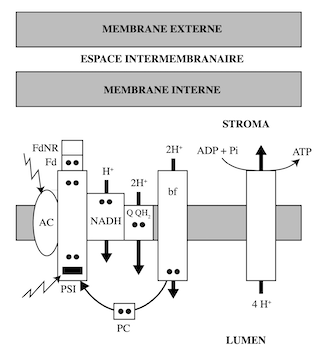
Ryochi Sato et al. (Tokyo University of Agriculture and Technology) et le groupe de Jean Wan Hong Yong (Department of Biosystems and Technology, Swedish University of Agricultural Sciences) ont souligné l’importance de la « photophosphorylation cyclique » ou « transport cyclique d’électrons » chez les plantes soumises à une situation de stress ou à des conditions climatiques extrêmes. Une intensité lumineuse excessive peut provoquer l’accumulation de dérivés réactifs de l’oxygène (radicaux libres, ions oxygénés, peroxydes…) susceptibles d’altérer les protéines membranaires des thylakoïdes ; le résultat de ces dommages est une production insuffisante d’équivalents réduits et d’ATP pour satisfaire les besoins de la plante. C’est pourquoi l’existence de la photophosphorylation cyclique, et le mécanisme de régulation permettant de passer du transport linéaire d’électrons au transport cyclique, sont d’une importance vitale pour les plantes. La photophosphorylation cyclique s’organise autour de PSI, à partir duquel les électrons à haute énergie passent, via la ferrédoxine, au cytochrome b6f en empruntant, soit la voie de la NADH-déshydrogénase (NADH dehydrogenase-like complex pathway) ; soit celle de l’hétérodimère PGR5/PGRL1 (Proton gradient regulation 5/PRG5-like photosynthetic phenotype 1) (PGR5/PGRL1-dependent Cyclic Electron Transport pathway). Les deux voies sont catalysées par des super-complexes résultant de l’association de PGR5/PGRL1 d’une part, et de la NADH-déshydrogénase d’autre part, à PSI. La plastocyanine ramène à PSI les électrons ayant perdu leur potentiel énergétique, ce qui boucle le cycle de la photophosphorylation cyclique.
Références : Sato, R et al. Significance of PGR5-dependent cyclic electron flow for optimizing the rate of ATP synthesis ans consumption in Arabidopsis chloroplasts (2019)
Ma, M. et al. The significance of chloroplast NAD(P)H dehydrogenase complex and its dependent cyclic electron transport in photosynthesis (2021).
Lorsque les électrons empruntent la voie PSI-PGR5/PGRL1, quatre H+ sont transportés de la face stromale vers la face luminale, et cinq dans le cas de la voie PSI-NADH-déshydrogénase. Deux H+ passent par le cycle de la quinone : Q/QH2. Deux autres H+ sont transportés par le cytochrome b6f et un par la NADH-déshydrogénase. Dans la photophosphorylation non-cyclique, l’énergie des électrons est utilisée pour synthétiser de l’ATP et réduire du NADP. Le passage en mode cyclique de PSI permet de pallier au déficit énergétique causé par les situations de stress ; la production de NADPH est court-circuitée au profit de la production de la quantité d’ATP nécessaire à la synthèse des hydrates de carbone, des acides aminés, des acides gras, ou pour convertir des nitrates ou des sulfates en composés organiques.
Synthèse du glucose et de composés organiques
Les êtres vivants sur la planète Terre dépendent étroitement des phototrophes (bactéries, cyanobactéries, algues, plantes supérieures). Ceux-ci synthétisent les produits dont les hétérotrophes se nourrissent, et produisent l’oxygène qu’ils respirent (à l’exception de certaines bactéries anaérobies). Il existe trois processus photosynthétiques fournissant l’énergie nécessaire à la synthèse de composés organiques (glucose, acides aminés, acides gras, carotènes, bases puriques et pyrimidiques) : (i) le mécanisme en C3 (C3 pathway of carbon fixation), baptisé cycle de Calvin-Benson, présent chez la quasi-totalité des plantes vertes ; (ii) le mécanisme en C4, baptisé cycle de Hatch et Slack, découvert à la fin des années 1950 par Hugo P. Kortschak et Yuri Karpilov, et décrit en détail, en 1966, par Marshall D. Hatch (The Commonwealth Scientific and Industrial Research Organization, Division of Plant Industry, Canberra) et Charles R. Slack (David North Plant Research Center, Brisbane) ; (iii) le mécanisme CAM (Crassulacean Acid Metabolism), présent chez les végétaux croissant dans les milieux désertiques pauvres en eau (Crassulacées, Kalanchoe).
En 1960, Melvin Calvin (University of California, Berkeley), James Bassham et Andrew A. Benson étudièrent la synthèse des sucres chez les végétaux ou, plus exactement, la fixation du CO2 atmosphérique dans un composé à trois carbones, pendant la phase chimique de la photosynthèse (phase sombre). En 1948, ils cultivèrent l’algue Chlorella pyrenoidosa dans une atmosphère contenant du 14CO2[5] . Après un temps de marquage très bref, ils procédèrent à l’extraction et à la séparation par chromatographie sur papier des produits radioactifs. Ils détectèrent par autoradiographie du phosphoglycérate marqué sur le groupe carboxylique. Ce composé ne se forme pas lorsqu’on incube des tissus animaux avec du 14CO2. Calvin en déduisit que le phosphoglycérate est l’un des premiers produits formés au cours du processus photosynthétique, après fixation du CO2 sur un composé X :
P représente le groupement phosphate PO4H2– ou plutôt, sa forme déprotonée HPO42-. Cette réaction se déroule en absence de lumière (phase sombre) et nécessite un apport en NADPH et ATP. Après de longues recherches l’accepteur X fut identifié au ribulose 1,5-bisphosphate. Ce sucre en C5 fixe une molécule de CO2 et donne naissance à un composé instable en C6, qui se dissocie en deux molécules de 3-phosphoglycérate :
Cette réaction de carboxylation est la première étape du cycle de Calvin-Benson. Elle est catalysée par la Rubisco (RibUlose BIS-phosphate Carboxylase Oxygénase), un complexe de Mr environ 500 000, composé de huit grosses sous-unités et de huit petites. Elle est présente dans le stroma des chloroplastes et chez les cyanobactéries. Pour un enzyme d’une telle importance pour les êtres vivants, il présente la curieuse particularité d’être paresseux : sa constante catalytique kcat (l’équivalent du nombre de molécules de substrat transformées par unité de temps et par molécule d’enzyme) est faible (kcat = 2 à 5 s-1) comparée à celles des championnes olympiques que sont l’anhydrase carbonique (kcat = 106 s-1) et la catalase (kcat = 4.107 s-1). La catalase transforme 40.000.000 de molécules de substrat (H2O2) pendant que la Rubisco n’en traite que deux à cinq ! La Rubisco compense sa faible efficacité par la quantité : elle est la protéine la plus abondante sur terre.
La première étape du cycle de Calvin, dans le stroma des chloroplastes, est la fixation de CO2 sur le ribulose 1,5- bisphosphate, catalysée par la Rubisco :
Un tour de cycle nécessite l’intervention de plus d’une douzaine d’enzymes. Deux molécules de 3-phosphoglycérate sont produites. Elles seront converties en glucose ou serviront à régénérer le ribulose 1,5-bisphosphate. La synthèse d’une molécule de glucose (en réalité de glucose 6-phosphate) nécessite la fixation de 6 CO2 et consomme 18 molécules d’ATP et 12 équivalents réduits (NADPH + H+) produits pendant la phase photochimique (phase claire). Cette dépendance aux protons explique pourquoi chez la plupart des végétaux le cycle de Calvin se déroule pendant le jour. Les glucides synthétisés s’accumulent dans les chloroplastes sous forme d’amidon, la forme de stockage des sucres chez les végétaux chlorophylliens. Melvin Calvin reçut le prix Nobel de Chimie en 1961.
Le cycle oxydatif photosynthétique du carbone (photosynthèse en C2), plus communément appelé Photorespiration, a été étudiée par le groupe de Thomas D. Sharkey (Department of Biochemistry and Molecular Biology, Michigan State University). La Rubisco se comporte comme une carboxylase dans le cycle de Calvin et comme une oxygénase dans le cycle oxydatif du carbone :
Le 3-phosphoglycérate produit entre dans le cycle de Calvin ; le 2-phosphoglycolate subit une série de réactions aboutissant à la production de CO2 et de NH3. Une douzaine d’enzymes, appartenant aux chloroplastes, aux mitochondries et aux peroxysomes catalysent ces réactions. On s’est interrogé sur la finalité de la Photorespiration, parfois qualifiée de réaction parasite dans la mesure où elle diminue le rendement en 3-phosphoglycérate, le carburant du cycle de Calvin. Selon la température ambiante, elle diminue de 20 à 40% le rendement de la photosynthèse et entraîne une consommation supplémentaire d’ATP et de NADPH. La spécificité de la Rubisco vis à vis du CO2 est faible. Lorsque la concentration en CO2 est élevée, sa fixation est favorisée. C’est ainsi que dans le cycle de Calvin, un quart seulement des molécules de Rubisco sont oxygénées et les trois quarts, carboxylées. Lorsque la concentration en CO2 est faible et celle en O2 élevée, la Photorespiration prédomine. Lorsque la température ambiante est élevée, comme sous les tropiques, la Rubisco fixe O2 plutôt que CO2. Chez les ancêtres des cyanobactéries actuelles, la photosynthèse était oxygénique ; la Rubisco a été en contact avec O2 avant de l’être avec CO2. La Photorespiration serait-elle une relique du passé que l’évolution n’a pas éliminée ? C’est loin d’être évident d’autant qu’elle a une utilité en permettant la fixation de l’azote des nitrates par les végétaux (métabolisme du phosphoglycolate). Au cours de la croissance des plantes, ou de leur réponse au stress, elle serait un élément essentiel de la « signalisation redox ».
Les chloroplastes possèdent leur propre patrimoine génétique. Arabidopsis thaliana est une plante annuelle à fleurs blanches. Son court cycle de vie – six semaines – et sa capacité à s’autoféconder en font un modèle d’étude prisé par les généticiens et les biologistes moléculaires. Son génome linéaire existe en de multiples exemplaires (polyploïdie) au sein de nucléoïdes, des complexes de haut poids moléculaire contenant aussi de l’ARN et des protéines (150 à 200, selon les espèces). Ils furent isolés en 1976 par Richard B. Hallick et coll. (Department of Chemistry, University of Colorado, Boulder) : « Isolation of a Transcriptionally Active Chromosome from Chloroplasts of Euglena gracilis »). Le génome chloroplastique fut séquencé à la fin du siècle dernier par S. Sato et coll. (Kazusa DNA Research Institute, Kisarazu) : « Complete Structure of the Chloroplast Genome of Arabidopsis », et par les chercheurs du Genome Analysis group : « Analysis of the genome sequence of the flowering plant Arabidopsis thaliana » ; 130 gènes codent pour 54 ARNr et ARNt, et 76 protéines, dont les quatre sous-unités d’une ARN polymérase (Plastid-encoded RNA polymerase). Plus de 4 000 gènes nucléaires assurent la synthèse des protéines et ARN non codés par le génome chloroplastique : dans le cas de la Rubisco, 15 sous-unités sur les 16 que comporte le complexe. Les chloroplastes possèdent leur propre machinerie de synthèse protéique (ARNm, ARNt). La structure et la composition des ribosomes chloroplastiques s’apparente à celle du ribosome bactérien.
- Henri Taube (prix Nobel de Chimie en 1983) fut un pionnier de l’étude des transferts d’électrons entre complexes métalliques.
- En chimie quantique, ces états sont : le premier état singulet (parce qu’il y a conservation du spin de l’électron) excité, l’état triplet métastable, le second état singulet excité, l’état triplet excité.
- La duplication des photosystèmes serait survenue il y a plus de 3 milliards d’années chez une cyanobactérie.
- Le potentiel du couple redox P700/P700+ est de + 400 millivolts ; celui du couple P700*/P700 de – 1300 millivolts. La différence de potentiel est de 1700 millivolts.
- Au département de chimie organique du Lawrence Radiation Laboratory, Melvin Calvin fut l’un des premiers à utiliser des radio-isotopes en biochimie métabolique.
- Athina Zouni et al. (Max-Volmer-Institut für Biophysikalische Chemie und Biochemie, Technische Universität Berlin) Crystal structure of photosystem II from Synechococcus elongatus at 3.8-Å resolution (2001).
- Nobuo Kamiya et al. (National Laboratory for High Energy Physics, Ibaraki) Crystal structure of oxygen-evolving photosystem II from Thermosynechococcus vulcanus at 3.7-Å resolution (2003).
- Zenfeng Liu et al. (National Laboratory of Biomacromolecules, Institute of Biophysics, Chinese Academy of Sciences, Beijing) Crystal structure of spinach major light-harvesting complex at 2.72 Å resolution (2004).
- Bernhard Loll et al. (Freie Universität Berlin) Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II (2005).
- Albert Guskov et al. (Institut für Chemie und Biochemie/Kristallographie, Freie Universität Berlin) Cyanobacterial photosystem II at 2.9 Å resolution and role of quinones, lipids, channels and chloride (2009).
- Matthias Broser et al. (Humboldt Universität, Berlin) Crystal structure of monomeric photosystem II from Thermosynechococcus elongatus at 3.6 Å resolution (2010).
- Yasufumi Umena et al. (Institute for Protein Research, Osaka University) Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å (2011).
- Cristina Pagliano et al. (Politecnico di Torino) Proteomic characterization and three-dimensional electron microscopy study of PSII-LHCII supercomplexes from higher plants (2014).
- Michihiro Suga et al. (Okayama University) Native structure of photosystem II at 1.95 Å resolution viewed by femtosecond X-ray pulses (2015).
- Xuepeng Wei et al. (University of Pennsylvania) Structure of spinach photosystem II-LHCII supercomplex at 3.2 Å resolution (2016).
- Hideo Ago et al. (Aoyama Gakuin University, Tokyo) Novel features of eukaryotic photosystem II revealed by its crystal structure analysis from a red alga (2016).
- Yuval Mazor et al. (Arizona State University) Structure of the plant photosystem I supercomplex at 2.6 Å resolution (2017).
- Xiaodong Su et al. (Northwestern Polytechnical University, Xi’an) Structure and assembly mechanism of plant C2S2M2-type PSII-LHCII supercomplex (2017).
- Liangliang Shen et al. (Photosynthesis Research Center, University of Chinese Academy of Sciences, Beijing) Structure of a C2S2M2N2-type PSII–LHCII supercomplex from the green alga Chlamydomonas reinhardtii (2019).