« Small Granules »
« In biology, as in mechanics, one of the best ways to figure out how something works is to break it. »
Gretchen Vogel
La révocation de l’Edit de Nantes par Louis XIV, en 1685, provoqua un exode massif des Huguenots français, dont certains choisirent de s’établir dans les colonies anglaises d’Amérique du nord ; parmi eux se trouvaient les ancêtres maternels de Francis Peyton Rous. A la fin de ses études de médecine à la Johns Hopkins University, le jeune Peyton s’orienta vers la recherche et sollicita l’octroi d’une bourse du Rockefeller Institute for Medical Research. Son directeur, Simon Flexner, avait lu avec intérêt un article de Rous sur les lymphocytes ; il l’invita à rejoindre la prestigieuse institution et à prendre la direction du laboratoire de recherches sur le cancer qu’il venait de quitter.
En 1911, Rous publia un article montrant que de petites quantité de filtrat de sarcome aviaire dépourvu de cellules peut transmettre cette tumeur très métastatique aux espèces sensibles. Loin d’être une tumeur spontanée, comme on le croyait, le sarcome aviaire est causé par un virus. L’importance de cette découverte échappa totalement à la communauté scientifique. Dans les années 1950, il sera établi que le virus du sarcome de Rous est un rétrovirus ; en médecine humaine, ces virus ont une sinistre réputation : ils sont responsables du syndrome d’immunodéficience acquise (SIDA) et de leucémies ; ils ont aussi un comportement qui parut hérétique aux biologistes des années 1950 : ils peuvent, grâce à une ADN polymérase particulière, appelée transcriptase réverse, synthétiser de l’ADN à partir d’une matrice d’ARN, remettant en cause le dogme d’un flux univoque d’information de l’ADN vers l’ARN. Rous fut donc le premier à montrer qu’un virus peut être l’agent causal d’un cancer. Il essaya, sans succès, de cultiver le virus et d’étendre la portée de ses résultats aux tumeurs de la souris. Confronté à la suspicion et aux critiques parfois virulentes de ses confrères, il abandonna, en 1915, ses recherches sur le sarcome. Les années passant, l’importance de la découverte de Rous sur l’agent du sarcome du poulet finit par s’imposer. Après avoir été assailli de critiques, Rous fut couvert de récompenses ; il reçut le prix Nobel de physiologie ou médecine 1966 comme on reçoit l’extrême onction – il avait quatre-vingt-sept ans – « for his pioneering research on the link between viruses and cancer. »
Référence : Rous P A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells (1911). Rous publia son article dans le Journal of Experimental Medicine, une prestigieuse revue créée par le pathologiste William H. Welch, fondateur de la Johns Hopkins School of Medicine et premier président du Board of Scientific Directors du Rockefeller Institute. Rous en deviendra l’éditeur en 1921 et le restera pendant près d’un demi-siècle.
Albert Claude consacra une partie de sa carrière scientifique à purifier le virus de Rous. Sa vocation pour la cancérologie expérimentale est à mettre en relation avec un drame familial vécu dans son enfance, et lié à cette maladie. Ayant quitté l’école à douze ans, il fut d’abord apprenti, puis dessinateur industriel. Il conservera du contact avec les réalités matérielles de l’industrie sidérurgique une aptitude particulière à maîtriser les problèmes techniques de l’instrumentation scientifique. Claude avait agi pendant la Première Guerre mondiale pour le compte du British Intelligence Service ; il fut décoré de la British War Medal, avec citation à l’ordre du jour signée par le Marshall Sir Douglas Haig et par le ministre de la Guerre Sir Winston Churchill. Le gouvernement belge ayant décrété que les anciens combattants pouvaient entrer à l’université sans diplôme ni examen d’entrée, il entreprit en 1922 des études de médecine à l’Université de Liège. Pour sa thèse de doctorat, il choisit comme sujet la greffe hétérologue de cellules cancéreuses chez le rat, travail pour lequel il obtint de J. A. Murray, directeur des Imperial Cancer Research Laboratories à Londres, l’envoi d’une souche du sarcome S-37 de la souris. La qualité de son mémoire lui valut, en 1928, l’octroi d’une bourse de séjour d’un an à l’Université de Berlin. Blumenthal, directeur de l’Institut für Krebsforshung, était un adepte de la théorie bactérienne du cancer et prétendait que la tumeur mammaire de la souris était transmissible par injection de bactéries. Claude montra que le sang injecté aux souris, s’il contenait bien les bactéries suspectées, renfermait aussi des cellules cancéreuses circulantes. Il ne lui restait plus qu’à plier bagages et à chercher un autre laboratoire. Dans celui d’Otto Warburg, au Kaiser Wilhem Institut, il s’initia, au contact d’Albert Fischer, à la culture des tissus et appliqua ses nouvelles connaissances au sarcome S-37. L’engouement pour la culture des cellules et des fragments de tissus était stimulé par l’intérêt des praticiens – Montrose T. Burrows à la Washington University, Alexis Carrel (prix Nobel de Physiologie ou Médecine, en 1912) au Rockefeller Institute for Medical Research – pour les transplantations d’organes. Des fragments de tissus (muscle cardiaque, moelle épinière) ou des cellules isolées étaient placés dans des milieux de survie contenant un cocktail varié de plasma sanguin, d’extraits d’embryon ou de lymphe. Les tissus conservaient leur vitalité. La publication de Ross Granville Harrison (John Hopkins University), eut un grand retentissement : les fibres de neuroblastes de grenouille en culture étaient animées de mouvements.
Référence : Harrison RG Observations on the living developing nerve fiber (1907)
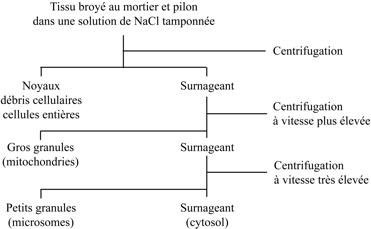
Claude découvrit en 1928 l’article de Peyton Rous sur « l’agent filtrant capable de transmettre le sarcome du poulet ». Enthousiasmé par sa lecture, il rédigea un projet de recherche visant à isoler le virus et l’envoya à Simon Flexner, directeur du Rockefeller Institute, responsable du Laboratory for Cancer Research, et éditeur du réputé Journal of Experimental Medecine. Il faut rendre hommage à l’ouverture d’esprit de Flexner qui accepta le projet d’un parfait inconnu et lui octroya un poste (assez mal rétribué) d’assistant volontaire. En 1929, Claude rejoignit le laboratoire de de James Murphy (Department of Pathology), un élève de Peyton Rous qui avait repris en 1920 le flambeau abandonné par son maître en 1915. Claude entreprit en 1930 le laborieux travail d’isolement de « l’agent filtrable causant le sarcome du poulet ». En 1936, il entendit parler des travaux de William E. Gye (National Institute for Medical Research, Hampstead) sur les sarcomes aviaires et l’emploi de la centrifugation pour en isoler les agents filtrables. Encore étudiant en médecine, Claude avait déjà eu recours à la centrifugation (avec une centrifugeuse de table actionnée à la main) pour isoler « les beaux granules rouge orangé des leucocytes éosinophiles » présents dans les tissus cancéreux et les expectorations des malades. Il prépara, un broyat d’embryons de poulets infectés par « l’agent I de la tumeur des poulets » ; il essaya plusieurs milieux d’homogénéisation : eau distillée, solution de chlorure de sodium, tampon phosphate de pH voisin de la neutralité. Il soumit le broyat à des centrifugations à vitesses croissantes.
La centrifugation dite différentielle sépare les particules essentiellement en fonction de leur taille. La rotation du rotor de la centrifugeuse génère une force centrifuge qui déplace les particules à une vitesse qui dépend de leur volume et, dans une moindre mesure, de leur densité. Les vitesses de déplacement sont calculées en utilisant l’équation de Theodor Svedberg (prix Nobel de chimie 1926). Pour déterminer les vitesses de rotation du rotor, Claude fit une estimation de la taille des organites à séparer, principalement les noyaux et les mitochondries. Il obtint ainsi un culot à basse vitesse contenant des noyaux et des cellules intactes ou partiellement broyées ; un culot à moyenne vitesse (« Large Granules ») formé de mitochondries ; un culot à haute vitesse (« Small granules » ou « Particles ») renfermant les virus qu’il cherchait à séparer. Ce culot avait un contenu élevé en « ribose nucleoprotein complexes » – le génome du virus de Rous est un ARN – et avait conservé un pouvoir infectieux : remis en suspension et injecté à des poulets ce culot transmettait le sarcome. L’expérience « contrôle » réservait une surprise : le culot de Small granules obtenu à partir d’embryons non infectés était dépourvu de pouvoir infectieux, comme on pouvait s’y attendre, mais il était gélatineux et riche en ARN ! Quelle était sa nature ? S’agissait-il d’un nouvel organite subcellulaire ? Claude publia ces résultats en 1938 ; un autre article, publié en 1947 avec Keith R. Porter et Edward G. Pickels, contenait une micrographie électronique montrant les amas de particules virales dans le cytoplasme de cellules infectées.
Claude consacra ses efforts à l’identification de l’organite riche en ARN présent dans les Small Granules. Il crut d’abord qu’il s’agissait de fragments de mitochondries, mais il acquit rapidement la certitude qu’il s’agissait d’un organite non encore identifié. Était-il spécifique des cellules d’embryon de poulet ? Était-il présent dans toutes les cellules eucaryotes ? Claude fractionna des tissus normaux et cancéreux, des tissus animaux et végétaux et des cellules de levure ; chaque fois, il obtint le même culot gélatineux, transparent, ambré, riche en phospholipides et renfermant jusqu’à 85% de l’ARN total du broyat. Au début des années 1940, les connaissances sur le contenu en organites de la cellule étaient limitées ; dans un article de 1943, Claude énumérait la liste des composants répertoriés par les cytologistes : noyau, mitochondries, appareil de Golgi, substance fondamentale et sarcode de Dujardin ! Pour caractériser le nouveau composant, il fallait « remonter » des Small particles (rebaptisées « microsomes », en 1943) à l’organite dans son contexte cellulaire, c’est-à-dire, suivre la démarche inverse de celle suivie par ses prédécesseurs – Friedrich Miescher, Martin Behrens, Robert Bensley – lorsqu’ils cherchaient à isoler un organite préalablement observé au microscope : le noyau, pour Miescher, les mitochondries dans le cas de Behrens ou de Bensley. Claude mit au point le fractionnement subcellulaire quantitatif en s’inspirant de l’approche des chimistes pour établir la composition d’un mélange de substances : les constituants chimiques (ARN, phospholipides, azote protéique) et enzymatiques furent mesurés dans l’homogénat et dans toutes les fractions, de façon à établir un bilan comparatif en pourcentage du contenu de l’homogénat. Claude publia en 1946 sa technique et sa « philosophie » du fractionnement.
Dans le même laboratoire que Claude (Department of Pathology, Rockefeller Institute), Walter Schneider s’intéressait à la localisation intracellulaire des enzymes respiratoires ; il avait montré que la cytochrome oxydase et la succinoxydase sédimentent dans la fraction des gros granules. L’examen microscopique de cette fraction révélait la présence de mitochondries sous forme de granules sphériques. L’eau et les solutions salines utilisées comme milieux d’homogénéisation provoquaient l’agglutination des organites. Il fallait trouver un milieu respectant la forme allongée caractéristique des mitochondries dans les cellules examinées au microscope. Les deux George, Hogeboom et Palade, qui avaient rejoint le groupe de Claude en 1941 et 1946 respectivement, allaient s’en charger. Hogeboom avait étudié la médecine et la chimie à Washington University. Sa motivation dans le choix d’une carrière scientifique n’était pas sans rappeler celle de Claude : le père d’Hogeboom était mort des suites d’un cancer. Pendant son séjour dans le laboratoire de Robert Chambers (New York University), George Palade, médecin et anatomiste, fut attiré vers la microscopie électronique après avoir assisté à une conférence de Claude, un pionnier de cette nouvelle technologie. Hogeboom, Schneider et Palade comparèrent les mérites respectifs de quatre milieux d’homogénéisation sur la morphologie et la colorabilité des mitochondries : solution de NaCl à 85%, eau distillée, saccharose 250 millimolaire (mM) ou 880 mM. C’est dans ce dernier milieu que les mitochondries étaient les mieux préservées. Finalement, c’est le saccharose 250 mM qui sera retenu comme milieu d’homogénéisation. Le broyage des tissus au mortier fut remplacé par l’usage de l’homogénéiseur de Potter et Elvejhem.
En 1949, Claude quitta New York pour Bruxelles, où il prit la direction de l’Institut Jules Bordet. La caractérisation du composant riche en ARN restait en chantier. L’hypothèse mitochondries étant devenue très improbable, une nouvelle piste fut explorée : l’origine des Small Granules serait le « lace-like reticulum », récemment découvert au microscope électronique. La dispersion du Rockefeller Group se poursuivit avec le départ de George Hogeboom pour les National Institutes of Health à Bethesda, où il étudia avec Walter Schneider la distribution subcellulaire de nombreux enzymes. Il disparut en 1956, à quarante-trois ans, en pleine maturité scientifique, après avoir créé le concept d’« enzyme marqueur » (d’un organite) qui allait permettre l’interprétation des résultats du fractionnement subcellulaire.
Références : Ledingham JCG, Gye WE On the Nature of the Filterable Tumour-Exciting Agent in Avian Sarcomata (1935)
Claude A A Fraction from Normal Chick Embryo Similar to the Tumor-Producing Fraction of Chicken Tumor I (1938)
Claude A, Porter KR, Pickels EG Electron Microscope Study of Chicken Tumor Cells (1947)
Claude A The constitution of protoplasm (1943)
Claude A Fractionation of mammalian liver cells by differential centrifugation: I. Problems, methods and preparation of extract (1946)
Claude A Fractionation of mammalian liver cells by differential centrifugation: II. Experimental procedures and results (1946)
Hogeboom G, Schneider WC, Palade GE Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material (1946)
« Lace-like reticulum »
« Our function is not to provide confirmatory morphological evidence for old concepts, but to define a new morphological background against which old and new physiological data will be interpreted in the future. »
George E. Palade
La commercialisation des microscopes électroniques en transmission Siemens et AEG (Allgemeine Elektricitäts-Gesellschaft) débuta en 1939 ; le microscope RCA (Radio Corporation America) fut mis sur le marché américain en 1941 ; celui de la firme Philips fut distribué en Europe en 1943. Un industriel new-yorkais, Albert Gessler, ayant eu connaissance des difficultés rencontrées par Claude pour identifier un virus provoquant un cancer, mit à sa disposition le microscope RCA EMB récemment acquis par le département de recherches d’Interchemical Laboratory, et l’aide d’Ernest F. Fullam pour apprendre à l’utiliser. Claude et Fullam examinèrent d’abord une préparation de mitochondries de lymphosarcome de rat, des organites dont l’observation au microscope optique avait révélé la morphologie. Ils s’associèrent ensuite à Keith Porter pour examiner une cellule entière. Porter avait mis au point une méthode de déshydratation des cellules animales en culture (l’examen au microscope électronique s’effectue sous vide). La micrographie d’un fibroblaste de poulet étalé sur une grille métallique et fixé dans les vapeurs d’acide osmique révélait la présence au sein de la substance fondamentale de la cellule d’un vaste réseau de membranes (« lace-like » reticulum) formé de chapelets de corps vésiculaires (vesicle-like bodies). Cette découverte amena plusieurs groupes de chercheurs, parmi lesquels Keith Porter et Helen P. Thompson (Rockefeller Institute for Medical Research), Albert J. Dalton (National Cancer Institute, Bethesda), Wilhelm Bernhard et Charles Oberling (Institut du Cancer du Centre National de la recherche scientifique, Villejuif), à s’intéresser à l’étude de la substance fondamentale des cellules.
Références : Claude A, Fullam EF An electron microscope study of isolated mitochondria (1945)
Porter KR, Claude A, Fullam EF A Study of Tissue Culture Cells by Electron Microscopy : Methods and Preliminary Observations. (1945)
La première micrographie électronique d’une cellule ne permettait de voir le détail des structures intracellulaires que sur le bord le plus mince de la préparation mais pas dans la région plus épaisse entourant le noyau. Le recours aux coupes de tissus s’imposait. Keith Porter, au Rockefeller Institute, et Fritiof S. Sjöstrand, au Karolinska Institutet, à Stockholm, mirent au point des techniques d’inclusion des tissus et de microtomie. Parmi les milieux de fixation des tissus qui furent proposés : tétraoxyde d’osmium (Keith Porter et Frances L. Kallman), permanganate de potassium et acroléine (John H. Luft, Department of Anatomy, Harvard Medical School), formaldéhyde (F. Blum), George Palade porta son choix sur le tétroxyde d’osmium, un oxydant puissant qui, en interagissant avec les acides gras des phospholipides rend les membranes cellulaires opaques aux électrons ; elles apparaissent sous forme de lignes noires sur fond clair. L’acidité provoquant la formation d’artefacts dans les tissus, Palade dilua l’acide osmique dans le tampon acétate/véronal de Michaelis (pH 7,2 à 7,6). Le « milieu de Palade », mis au point en 1952, fut universellement adopté. En 1961, David Sabatini introduisit la glutaraldéhyde, qui présente l’avantage de préserver l’activité des enzymes ; de plus, ce milieu pénètre mieux dans les tissus que l’acide osmique et permet de fixer des échantillons volumineux. Pour l’inclusion des échantillons, Newman et coll. proposèrent un milieu à base de méthyl ou de butyl méthacrylate, qui se solidifient par dessiccation au four. Le méthacrylate s’étant révélé instable sous un faisceau d’électrons, il fut remplacé en 1956 par les résines époxy. Pour couper les échantillons inclus dans un milieu solide, Ernest Fullam, chez Interchemical Laboratory, avait conçu un microtome. Keith Porter et Joseph Blum, dans l’atelier du Rockefeller Institute, ajoutèrent un mécanisme d’avance du couteau, préservant la surface du bloc à couper, et un réservoir de liquide pour recueillir les coupes par flottaison, afin d’éviter qu’elles ne se recroquevillent avant d’être déposées sur une grille métallique. Le microtome « Porter-Blum » fut achevé dans les années 1950 et largement adopté dans les laboratoires de microscopie électronique. Harrisson Latta et J. Francis Hartmann (Department of Biology, Massachusetts Institute of Technology, Cambridge) utilisèrent des couteaux de verre, bientôt remplacés par des couteaux en diamant, plus chers mais beaucoup plus résistants. Avec des coupes de 20 à 40 nm d’épaisseur, on pouvait atteindre une résolution inférieure à une dizaine de nm.
Références : Porter K, Kallman F The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy (1953)
Luft JH Permanganate—a new fixative for electron microscopy (1956)
Luft JH The use of acrolein as a fixative for light and electron microscopy (1959)
Luft JH Improvements in epoxy resin embedding methods (1961)
Newman SB, Borysko E, Swerdlow M New sectioning techniques for light and electron microscopy (1949)
Porter KR, Blum J A study in microtomy for electron microscopy (1953)
Sjostrand FS A new microtome for ultrathin sectioning for high resolution electron microscopy (1953)
Latta H, Hartmann JF Use of a Glass Edge in Thin Sectioning for Electron Microscopy (1950)
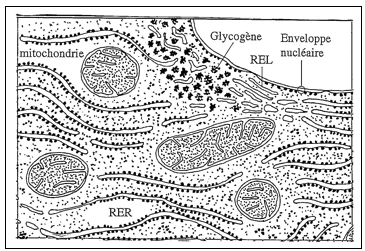 |
| Reticulum endoplasmique d’une cellule hépatique. RER : reticulum endoplasmique rugueux ; REL reticulum endoplasmiqur lisse. |
Keith Porter et Frances L. Kallman montrèrent que les éléments du réseau membranaire cytoplasmique sont en continuité entre eux formant ainsi un organite unique. Cet organite polymorphe (saccules, tubules, vésicules) a tendance à se fragmenter en vésicules au cours de l’homogénéisation des tissus. Dès 1948, Claude avait émis l’hypothèse que les microsomes dérivent du réseau membranaire cytoplasmique. Le lien fut établi par George Palade ; il proposa que l’homogénéisation provoque la formation des vésicules microsomiales par pincement de la membrane du réticulum (pinching off process). D’un diamètre moyen de 130 nm, les vésicules microsomiales sont lisses (sans ribosomes liés) ou rugueuses (avec des ribosomes liés). Fait remarquable, elles conservent l’architecture du réticulum endoplasmique, dont la membrane sépare le cytoplasme d’un espace interne appelé « lumen » ou, plus rarement, « réticuloplasme ». La face externe des vésicules correspond à la face cytoplasmique de la membrane ; le contenu vésiculaire correspond au réticuloplasme et les ribosomes restent liés à la face externe des vésicules microsomiales rugueuses. J. Francis Hartman et Michael L. Watson montrèrent que la membrane du reticulum est en continuité avec la membrane externe de l’enveloppe nucléaire. A cette occasion, apparut pour la première fois l’appellation « reticulum endoplasmique ». Fritiof Sjöstrand et V. Hanzon (Department of Anatomy, Karolinska Institutet, Stockholm) complétèrent la description du réseau membranaire cytoplasmique par celle des tubules et des citernes de l’appareil de Golgi.
Références : Porter K, Kallman FL Significance of Cell particulates as seen by electron microscopy (1952)
Palade GE, Siekevitz P Liver microsomes; an integrated morphological and biochemical study (1956)
Sjöstrand FS, Hanzon V Ultrastructure of Golgi apparatus of exocrine cells of mouse pancreas (1954)
Jean L. Brachet (Université libre de Bruxelles) et Torbjörn O. Casperson (Karolinska Institutet) découvrirent, indépendamment, le rôle de l’ARN dans la synthèse des protéines ; les cellules où cette synthèse est très active sont riches en ARN. Albert Claude avait montré qu’une grande proportion de l’ARN de la cellule se retrouve dans les microsomes ; leur implication dans la synthèse protéique fut établie par Henry Borsook (California Institute of Technology) et par Tore Hultin (Wenner-Gren Institute for Experimental Biology, Stockholm). A la fin des années 1940, des traceurs radioactifs (14C, 3H, 32P, 35S) furent mis à la disposition des biochimistes. Paul C. Zamecnik et coll. (Huntington Laboratories of Harvard University, Massachusetts General Hospital, Boston) montrèrent que chez des rats auxquels ils avaient injecté des acides aminés radioactifs, la radioactivité est associée aux microsomes. Cyrus P. Barnum et Robert A. Huseby (National Institute of Health, Bethesda), et Mary L. Petermann (Sloan Kettering Institute, New York) obtinrent par centrifugation à haute vitesse d’un surnageant post-microsomial des particules impliquées dans la synthèse protéique ; les « ultra microsomes » de Barnum et les « macromolécules de ribonucléoprotéine » de Peterman étaient plus petits que les vésicules microsomiales et avaient un rapport ARN/protéine plus élevé. En 1953, Palade observa au microscope électronique des grains opaques aux électrons dans le cytoplasme des cellules ; il les appela « Small Particulate Components », ou « Ribonucleoprotein Particles ». Longtemps appelés « grains de Palade », ces particules furent rebaptisés « ribosomes » par Howard M. Dintzis (Department of Biology, Massachusetts Institute of Technology) et par J.M. Robertson, en 1958.
Références : Brachet J La localisation des acides pentosenucléiques dans les tissus animaux et les oeufs d’Amphibiens en voie de développement (1942)
Borsook H, Deasy CL, Haagen-Smit AJ, Keighley G, Lowy PH The uptake in vitro of 14C-labelled glycine, L-leucine, and L-lysine by different components of guinea pig liver homogenate (1950). Henry Borsook travaillait dans le Département de biologie fondé par Thomas H. Morgan au California Institute of Technology, à Pasadena.
Littlefield JW, Keller EB, Gross J, Zamecnik PC Studies on cytoplasmic ribonucleoprotein particles from the liver of the rat (1955)
Barnum CP, Huseby RA Some quantitative analyses of the particulate fractions from mouse liver cytoplasm (1948)
Petermann ML, Hamilton MG An ultracentrifugal analysis of the macromolecular particles of normal and leukemic mouse spleen (1952)
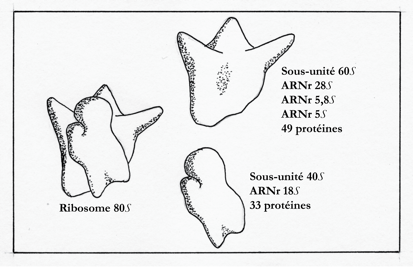
Alfred Tissières et James Watson (Harvard) montrèrent que le ribosome d’Escherichia Coli est dissociable en deux entités, une grande et une petite, composées chacune de protéines et d’ARN. Au terme d’un impressionnant travail d’analyse, Masayasu Nomura et ses associés (Laboratory of Genetics, University of Wisconsin, Madison) établirent la composition en ARN et en polypeptides de ces sous-unités ribosomiales. Dans les solutions salines concentrées, les sous-unités se dissocient en ARNr et protéines ; il suffit de ramener progressivement le taux de salinité à une valeur voisine de celui du cytosol, pour que l’ARNr et les polypeptides s’associent spontanément en ribosomes. Chez Escherichia Coli, la petite sous-unité 30S est constituée de l’ARNr 16S et de 21 protéines ; la grande sous-unité 50S, des ARNr 5S et 23S et de 33 protéines. Chez les eucaryotes, la grande sous-unité 60S renferme les ARNr 28S, 5,8S et 5S et 49 protéines ; la petite sous-unité 40S est constituée de l’ARNr 18S et de 33 protéines. La petite sous-unité contient le site de lecture de l’ARNm ; la grande sous-unité, possède le site catalytique où se fait la liaison peptidique (Peptidyl-transferase center). Walter Gilbert (Harvard University, prix Nobel de chimie 1980), co-découvreur de l’ARNt avec Mahlon Hoagland, montra que les peptides néo-synthétisés sont liés à la grosse sous-unité ribosomiale, et que l’association des ribosomes en polysomes augmente considérablement la vitesse de lecture de l’ARNm et de synthèse des polypeptides. Dans les cellules tumorales en culture, où le taux de division est élevé, l’ARNr peut représenter jusqu’à 80% de l’ARN total des cellules ; les 20% restant sont des ARN de transfert (ARNt), des ARN messagers (ARNm), des ribonucléoprotéines non ribosomiales et des ARN divers. Un progrès majeur dans l’étude de la synthèse protéique fut accompli, au début des années 1950, avec la mise au point d’un système acellulaire constitué d’un surnageant de foie de rat additionné d’acides aminés, d’ATP et d’une mixture régénérant l’ATP. Dans le laboratoire de Zamecnik, la quantité de peptides synthétisés in vitro était très faible. K. Mc Qillen obtint, en 1960, des résultats plus convaincants avec des ribosomes d’Escherichia coli incubés en présence d’acides aminés radioactifs.
Références : Tissières A, Watson JD Ribonucleoprotein particles from Escherichia Coli (1958)
Hosokawa K, Fujimura RK, Nomura M Reconstitution of functionally active ribosomes from inactive subparticles and proteins (1966)
Palade GE A small particulate component of the cytoplasm (1955)
Un exploit scientifique :
la structure cristallographique du ribosome
Dans les années 1980, deux groupes de chercheurs entreprirent le fastidieux travail consistant à obtenir des cristaux de ribosomes et de sous-unités ribosomiales. A cette époque, la possibilité d’établir par cristallographie aux rayons X la structure de machines moléculaires aussi volumineuses (des dizaines de milliers d’atomes) suscitait un scepticisme quasi général. Les groupes d’Alexander S. Spirin (Université d’État Lomonosov, Moscou) et d’Ada E. Yonath (Weizmann Institute of Science, Rehovot) se lancèrent néanmoins dans la préparation de cristaux de qualité suffisante pour l’analyse cristallographique. Ils choisirent comme matériel expérimental des ribosomes de bactéries résistantes aux températures élevées (thermophilie) (Bacillus stearothermophilus, Thermus thermophilus), aux milieux de salinité élevée (halophilie) (Haloarcula morismortui, Halobacterirum marismortui), ou aux radiations ionisantes (Deinococcus radiodurans), plus susceptibles de résister aux conditions dénaturantes de l’analyse aux rayons X que ceux d’Escherichia coli, par exemple. Avec l’inestimable soutient de Heinz-Günter Wittmann (Max-Planck-Institut für Molekulare Genetik, Berlin-Dahlem), Yonath vit sa persévérance récompensée ; au fil des années, elle obtint des cristaux diffractant à des résolutions toujours plus élevées : 15 à 18 Å (1984), 6 Å (1987), 4,5 Å (1999), 3,1 Å (2001). La voie de l’analyse cristallographique des ribosomes et de leurs sous-unités était ouverte. Utilisant les méthodes mises au point dans les laboratoires de Spirin et de Yonath, plusieurs groupes s’y engouffrèrent, parmi lesquels ceux de Thomas A. Steitz et Peter B. Moore (Howard Hughes Medical Institute, Yale University) et de Venkatraman Ramakrishnan (Medical Research Council Laboratory of Molecular Biology, Cambridge). Steitz et Moore résolurent la structure cristallographique de la sous-unité 50S à 9 Å (1998) puis à 5 Å (1999) et 2,4 Å (2000). Préalablement, Moore avait utilisé la diffusion des neutrons aux petits angles (Small-angle neutron scattering) pour faire une cartographie tridimensionnelle des 21 protéines de la petite sous-unité du ribosome d’Escherichia coli. Ramakrishnan élucida la structure de la sous-unité 30S à 5,5 Å (1999) puis à 3 Å (2000). Connaître la structure atomique des ribosomes est d’un intérêt considérable, non seulement en biologie fondamentale mais aussi en thérapeutique : les ribosomes bactériens sont la cible de la majorité des antibiotiques utilisés en médecine humaine et animale. Ramakrishnan, Steitz et Yonath partagèrent le prix Nobel de Chimie 2009.
Références : Marvin Friedman S Protein-synthesizing Machinery of Thermophilic Bacteria (1968)
Yonath A, Miissig J, Tesche H, Lorenz S, Erdmann VA, Wittmann HG Characterization of crystals of small ribosomal subunits (1980)
Yonath A, Saper MA, Frolow F, Makowski I, Whittmann HG Characterization of single crystals of the large ribosomal particles from a mutant of Bacillus stearothermophilus (1986)
Makowski I, Frolow F, Saper MA, Shoam M, Whittmann HG, Yonath A Single crystals of large ribosomal particles from Halobacterium marismortui diffract to 6 Å (1987)
Glotz C, Müssig J, Gewitz HS, Makowski I, Arad T, Yonath A, Whittmann HG Three-dimensional crystals of ribosomes and their subunits from eu- and archabacteria (1987)
Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A Structure of functionally activated small ribosomal subunit at 3.3 Å resolution. Cell (2000)
Yusupov MM, Trakhanov SD, Barinin VV et al. Crystallization of 30S subunits of ribosome of Thermus thermophilus (1987)
Trakhanov SD, Yusupov MM, Agaralov SC, Garber MB et al Crystallization of 70S ribosomes and 30S ribosomal subunits from Thermus thermophilus (1987)
Yusupov MM, Tischenko SV, Trakhanov SD, Ryazantsev SN, Garber MB A new crystallin form of 30S ribosomal subunits from Thermus thermophilus (1988)
Yusupov MM, Garber MB, Vasiliev VD, Spirin AS. Thermus thermophilus ribosomes for crystallographic studies (1991)
Capel MS, Moore PB Quaternary structure of the small ribosomal subunit of Escherichia Coli determined by neutron diffraction (1988)
Ban N, Freeborn B, Nissen P, Penczek P, Grassucci RA, Sweet R, Frank J, Moore PB, Steitz TA A 9 Å resolution X-ray crystallographic map of the large ribosomal subunit (1998)
Ban N, Nissen P, Hansen J, Moore PB, Steitz TA The complete atomic structure of the large ribosomal subunit at 2.4 Å resolution (2000)
Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V Structure of the 30S ribosomal subunit (2000)
La synthèse protéique débute dans le cytosol par l’association de l’ARNm et de la petite sous-unité ribosomiale. Masayasu Nomura montra que cette première étape est immédiatement suivie de l’ancrage de la grosse sous-unité, aboutissant ainsi à la formation d’un ribosome fonctionnel. C’est la phase d’initiation. Avec la traduction de l’ARNm par le ribosome, commence l’élongation du polypeptide. La lecture codon par codon des instructions portées par l’ARNm entraîne la sélection d’un acide aminé qui s’ajoute à la chaîne peptidique naissante. La peptidyltransférase ribosomiale catalyse le transfert de la chaîne peptidique sur l’acide aminé choisi (lié à son ARNt spécifique sous forme d’aminoacyl ARNt). La terminaison de la traduction a lieu lorsque le déplacement du ribosome sur l’ARNm l’amène devant le codon stop, indiquant la fin du message traduit. L’ARNm se détache et le ribosome se dissocie en sous-unités. Raymond O.R. Kaempfer, Matthew S. Meselson et Heschel J. Raskas (The Biological Laboratories, Harvard University, Cambridge) ont décrit le cycle d’association des sous-unités en ribosomes fonctionnels, et de dissociation des ribosomes en sous-unités. Pour différencier les ribosomes « anciens » des ribosomes et sous-unités nouvellement synthétisés, ils firent croître Escherichia coli dans un milieu contenant les isotopes « lourds » 13C du carbone, 15N de l’azote et 3H de l’hydrogène. Les bactéries renfermant les ribosomes 70S « lourds » marqués au 13C, 15N et 3H furent transférées dans un milieu de culture sans isotopes et incubées le temps nécessaire à la synthèse de nouveaux ribosomes. Après broyage des cellules, la centrifugation en gradient de densité permit de séparer trois bandes distinctes : une bande dense de ribosomes lourds (13C, 15N, 3H), une bande de densité intermédiaire de ribosomes dont seule la grosse (50S), ou la petite (30S) sous-unité étaient marquées, et une bande « légère » de ribosomes 70S.
La synthèse protéique est un processus centralisée : en 1972, Michael Rosbash (Department of Biology, Massachusetts Institute of Technology, Cambridge, prix Nobel de physiologie ou médecine 2017) montra que la traduction débute toujours sur les polysomes cytosoliques ; elle se poursuit dans le cytosol pour les protéines « domestiques » cytosoliques, nucléaires, nucléolaires et peroxysomiales, pour certaines protéines mitochondriales ou chloroplastiques ; elle se poursuit sur les polysomes liés au réticulum endoplasmique reticulum endoplasmique rugueux) pour les protéines membranaires du reticulum, du complexe de Golgi, et de la surface cellulaire, pour les protéines sécrétoires stockées dans les granules de sécrétion et exportées hors de la cellule. Le site où une protéine exerce sa fonction est donc généralement différent du site de synthèse, ce qui implique un transport de protéines entre les deux sites. Les cellules qui fabriquent de grandes quantités de protéines sécrétoires (cellules pancréatiques, hépatocytes, plasmocytes, fibroblastes) possèdent un réticulum endoplasmique rugueux développé. Les cellules des procaryotes ou les réticulocytes (les globules rouges du sang), qui fabriquent essentiellement des protéines « domestiques », sont dépourvues de système endomembranaire ; leurs ribosomes sont libres dans le milieu intracellulaire.
Références : Kaempfer ROR, Meselson MS, Raskas HJ Cyclic dissociation into stable subunits and re-formation of ribosomes during bacterial growth (1968)
Rosbash M Formation of membrane-bound polysomes (1972)
Microsomes
Le terme « microsomes » a une connotation opérationnelle ; il désigne la fraction particulaire obtenue par centrifugation d’un surnageant post-mitochondrial à vitesse élevée (40.000 rpm pendant 30 à 60 minutes ou plus, selon les auteurs) dans un rotor angulaire (rotor Spinco 40). En 1955, George Palade et Philip Siekevitz identifièrent trois composants des microsomes : les vésicules lisses ou rugueuses dérivant de la fragmentation du réticulum endoplasmique et les ribosomes. Dans un article publié en 1962, Palade et Lars Ernster écrivaient : « It is well established that the microsomal fraction isolated from rat liver by usual differential centrifugation from rat liver homogenates consists of vesicular and tubular fragments of the endoplasmic reticulum. » Cette affirmation était tempérée dans la discussion : les auteurs évoquaient la présence possible d’éléments de la membrane péricellulaire. Dans un article antérieur (1956), ces mêmes auteurs avaient évoqué la présence d’éléments du complexe de Golgi dans la fraction microsomiale. Il faut voir dans ces affirmations de scientifiques reconnus l’origine de la confusion qui a perduré jusqu’au milieu des années 1970 entre microsomes (la fraction subcellulaire) et reticulum endoplasmique (l’organite).
La composition membranaire de la fraction microsomes dépend de façon critique de la façon dont elle a été préparée. Si l’objectif est d’obtenir des microsomes représentatifs du reticulum endoplasmique, il est impératif de respecter toutes les étapes du fractionnement en préparant d’abord une fraction nucléaire, puis une fraction mitochondriale et enfin des microsomes par centrifugation du surnageant post-mitochondrial. Il est impératif de procéder à un « lavage » de chaque culot : remise en suspension et centrifugation. Cette étape doit être effectuée deux fois pour chaque culot. Elle diminue la contamination du culot nucléaire par les organites de la fraction mitochondriale (mitochondries, lysosomes, peroxysomes). La vitesse de rotation du rotor, et par conséquent la force centrifuge, est calculée pour qu’une particule de la taille d’un noyau (5-7 micromètres de diamètre) parcourt la distance séparant le ménisque du liquide et le fond du tube du rotor. Dans ces conditions, une particule de la taille d’une mitochondrie (3 micromètres) se trouvant au milieu du tube au début de la centrifugation atteindrait le culot. La remise en suspension suivie de centrifugation, diminue donc la contamination inhérente au modus operandi, bien qu’un certain nombre d’expérimentateurs ont choisi de prépare le surnageant post-mitochondrial par sédimentation « en bloc » des fractions nucléaire et mitochondriale. La recommandation de préparer séparément ces deux fractions peut paraître triviale, mais elle est essentielle. En 1974, avec Henri Beaufay et un certain nombre de collègues, nous avons publié une série d’articles décrivant nos résultats obtenus entre 1965 et 1969 (la liste de ces articles est donnée dans le paragraphe « Bibliographie », à la fin du chapitre) : sur la base de la proportion des enzymes marqueurs des différents types de membrane, nous avions calculé que dans les microsomes tels que nous les préparions 77% des protéines provenaient du reticulum endoplasmique. La fraction contenait 75% de la glucose 6-phosphatase de l’homogénat, un enzyme marqueur du reticulum. Les 23% de protéines microsomiales restant venaient de la membrane péricellulaire (8%), des mitochondries (4,9%), du complexe de Golgi (4,3%), des peroxysomes (0,8%) et des lysosomes (0,5%). Loin de l’affirmation de Lars Ernster et Gustav Dallner (Karolinska Institutet, Stockholm) dans un article de 1968 : « The pellet constituents vary according to the tissue of origin : thus rough and smooth ER membranes are practically the only pellet constituent from liver tissue… », les microsomes de foie de rat contenaient, en plus des vésicules dérivant du reticulum endoplasmique, les membranes de deux autres compartiments (complexe de Golgi et membrane plasmique), ainsi qu’une proportion non négligeable de gros granules (mitochondries lysosomes, peroxysomes). La teneur en ARN (0,10 milligramme par milligramme de protéine) traduisait l’absence à peu près complète de polysomes libres dans nos microsomes. Le critère ARN/protéine fut utilisé pour la première fois par Abert Claude, le découvreur des microsomes, et repris en 1960 par Yvonne Moulé, Charles Rouiller et Jean Chauveau (Centre de Recherches sur la Cellule Normale et Cancéreuse, à Villejuif). Il faut se souvenir que pendant longtemps la seule fonction attribuée aux microsomes était la synthèse protéique. Dans la littérature, figurent des valeurs comprises entre 0,07 et 0,27 milligramme d’ARN par milligramme de protéine. Ces différences de 1 à 4, reflètent la variabilité des conditions d’obtention des microsomes obtenus par différents auteurs. Un rapport de 0,27 milligramme d’ARN par milligramme de protéine caractérise des microsomes fortement contaminés par des polysomes libres.
Microsomes lisses, microsomes rugueux
Les idées simplistes ont la vie dure
L’examen au microscope électronique de coupes de tissus hépatique ou pancréatique a révélé que le reticulum endoplasmique est formée de portions lisses, dépourvues de ribosomes, et de portions rugueuses, portant des ribosomes attachés à la face cytoplasmique de la membrane. La fragmentation en vésicules du reticulum endoplasmique lors de l’homogénéisation du tissus fut le point de départ de nombreuses tentatives de séparation des vésicules lisses ou rugueuses. L’on attribuait aux deux populations des fonctions spécifiques : la synthèse protéique pour les vésicules rugueuses et le métabolisme des xénobiotiques (voir plus loin) pour les vésicules lisses. La méthode la plus rapide et la plus directe pour effectuer cette séparation faisait appel à la centrifugation sur des couches de saccharose de densité décroissante, superposées dans le tube d’un rotor. La densité d’équilbre dans le saccharose des vésicules lisses est comprise entre 1,05 et 1,18, et celle des vésicules rugueuses, entre 1,18 et 1,25 g.cm-3. Il suffisait donc de choisir en fonction de ces données la densité des deux (ou plus) couches de saccharose. Dans le cas le plus simple (deux couches de saccharose), après centrifugation pendant une durée déterminée, généralement assez longue, on voyait se former à l’interface des deux couches une bande de microsomes lisses, et au fond du tube, un culot de microsomes rugueux. Le problème avec cette méthode de séparation sur « gradient discontinu », c’est que les prémisses étaient fausses.
A l’issue d’un méticuleux travail de morphologie quantitative, Maurice Wibo démontra, en 1971, que la charge en ribosomes des vésicules couvre tout le spectre allant de la vésicule lisse à celle ayant la charge maximale en ribosomes. Il n’y a donc pas deux populations distinctes sur la base de la charge en ribosomes des vésicules. Après centrifugation en gradient linéaire de saccharose, les enzymes marqueurs du reticulum endoplasmique (glucose 6-phosphatase et NADPH-cytochrome c réductase) sont distribués dans la totalité du gradient, de la densité 1,10 à la densité 1,27g.cm3. Ces distributions étalées reflétent le caractère « polydisperse » des vésicules : elles s’équilibrent dans le gradient en fonction de leur charge en ribosomes, les vésicules lisses dans la portion légère du gradient et les vésicules à forte charge en ribosomes dans la partie du gradient où la densité est la plus élevée ; entre les deux, s’étale un spectre continu de vésicules dont la densité d’équilibre croît proportionnellement à la charge en ribosomes. Ce résultat invalide la signification des résultats expérimentaux établissant un lien entre les propriétés biochimiques et enzymatiques des microsomes et leur caractère lisse ou rugueux. La centrifugation sur couches de saccharose de densités différentes pour séparer deux populations de vésicules, pratiquée dans de nombreux laboratoires, introduit une coupure arbitraire au sein d’une population continue de vésicules dont les propriétés biochimiques varient en proportion mais pas en nature ; il y a moins d’oxygénases à fonction mixte dans les vésicules très rugueuses que dans les vésicules lisses, mais il y en a.
Référence : Wibo M, Amar-Costesec A, Berthet J, Beaufay H Electron Microscope Examination of Subcellular Fractions. III. Quantitative Analysis of the Microsomal Fraction Isolated from Rat Liver (1971)
« Membrane flow » versus
Homogénéité biochimique des membranes
Au cours de la décennie 1960-1970, plusieurs groupes de chercheurs purifièrent des membranes cellulaires et établirent leur composition biochimique. La membrane péricellulaire, isolée en 1960 par David M. Neville (Department of Pathology, University of Rochester School of Medicine and Dentistry), renferme des enzymes hydrolysant les liaisons ester- ou diester-phosphate (phosphatase alcaline, phosphodiestérase alcaline I, 5’-nucléotidase) ; cette dernière hydrolyse les nucléotides puriques, adénine et guanine ; le complexe de Golgi, isolé en 1969 par Rebecca Fleischer, Sidney Fleisher et Hidehiro Ozawa (Department of Molecular Biology, Vanderbilt University, Nashville) contient les galactosyl- et sialyltransférases ; la membrane externe des mitochondries, isolée par D.F. Parsons, G.R. Williams et Britton Chance (Department of Biophysics and Physical Biochemistry, Johnson Foundation, University of Pennsylvania, Philadelphia), renferme la monoamine oxydase, une oxydase à fonction mixte catalysant l’oxydation des monoamines biologiques comme la sérotonine. La glucose 6-phosphatase (une phosphatase participant à la régulation du taux sanguin de glucose) et la NADPH cytochrome c réductase (une oxydoréductase de la chaîne respiratoire du reticulum endoplasmique) ont leur pic d’activité spécifique le plus élevé dans les microsomes, dont le composant principal dérive de la fragmentation en vésicules du reticulum endoplasmique. Chaque préparation membranaire prise individuellement renferme des enzymes qui lui sont spécifiques mais aussi une certaine proportion d’enzymes caractéristiques des autres types membranaires. Il y a deux interprétations possibles à cet état de fait : (i) soit on suppose que ces enzymes caractéristiques des autres types membranaires contaminent les préparations les plus « pures » que l’on puisse obtenir ; (ii) soit un enzyme donné n’est pas exclusivement associé à un seul type de membrane. En d’autres termes, les différents compartiments membranaires différent-ils entre eux qualitativement ou quantitativement ? La réponse à cette question est cruciale pour concevoir un mécanisme de la biogenèse des membranes et, d’une manière plus générale, des différents compartiments de la cellule. La première hypothèse était celle qui avait la faveur des membres du Groupe de Louvain, conformément au postulat d’homogénéité sur lequel Jacques Berthet et Christian de Duve avaient fondé l’approche quantitative du fractionnement subcellulaire. L’analyse de la fraction des gros granules, qui avait conduit à la découverte des lysosomes et des peroxysomes, avait été conduite en appliquant ce postulat. La seconde hypothèse semblait être en faveur parmi les microscopistes du groupe de George Palade. En 1974, Marylin Farquhar avait détecté la présence de phosphatase acide, un enzyme des lysosomes, et d’adénylate cyclase et de 5’-nucléotidase, deux enzymes de la membrane plasmique, dans le complexe de Golgi. Des localisations multiples furent rapportées par d’autres membres du groupe (cités dans Références II). De ces résultats, on pouvait conclure que les membranes des différents types présentaient entre elles des différences quantitatives et non qualitatives. Le « model of flow-differentiation » (ou « membrane flow »), formulé par D. James Morré (Department of Chemistry and Pharmacology, Purdue University, West Lafayette) était l’interprétation poussée à l’extrême de cette option : il existerait un gradient de concentration en enzymes le long de la voie sécrétoire, du réticulum vers la membrane plasmique ; la teneur en glucose 6-phosphatase élevée dans le réticulum, irait en diminuant du reticulum au complexe de Golgi et du complexe de Golgi à la membrane péricellulaire ; à l’inverse la concentration en 5’-nucléotidase irait en décroissant de la membrane plasmique au complexe de Golgi et au reticulum endoplasmique. Au cours de ce processus, les compartiments de la chaîne d’assemblage et de transport des protéines (reticulum endoplasmique, complexe de Golgi, membrane péricellulaire) établissent entre eux des continuités anatomiques, au moins transitoires. Si l’on prend en compte la fluidité de la bicouche lipidique, on se demande à juste titre comment ces compartiments acquièrent et maintiennent une stricte individualité biochimique.
Références : Neville DM The Isolation of a Cell Membrane Fraction from Rat Liver (1960)
Fleischer R, Fleisher S, Ozawa H Isolation and characterization of Golgi membranes from bovine liver (1969)
Parsons DF, Williams GR, Chance B Characteristics of isolated and purified preparations of the outer and inner membranes of mitochondria (1966)
Farquhar MG, Bergeron JJM, Palade GE Cytochemistry of Golgi fractions prepared from rat liver (1974)
Cheng H, Farquhar MG Presence of adenylate cyclase activity in Golgi and other fractions from rat liver. II. Cytochemical localization within Golgi and ER membranes (1976)
Borghese N, Meldolesi J Localization and biosynthesis of NADH cytochrome b5 reductase, an integral membrane protein, in rat liver cells. I. Distribution of the enzyme activity in microsomes, mitochondria, and Golgi complex (1980)
Howell KE, Ito A, Palade GE Endoplasmic marker enzymes in Golgi fractions. What does this mean? (1978)
Ito A, Palade GE Presence of NADPH-cytochrome P450 réductase in rat liver Golgi membranes. Evidence obtained by immunoadsorption method (1978)
Widnell CC Cytochemical localization of 5’-nucleotidase in subcellular fractions isolated from rat liver. I. The origin of 5’-nucleotidase activity in microsomes (1972)
Jarash ED, Kartenbeck J, Bruder G, Fink A, Morré DJ, Franke WW B-type cytochromes in plasma membranes isolated from rat liver, in comparison with those of endomembranes (1979)
En mai 1979, Günter Blobel (Department of Cell Biology, The Rockefeller University) et David Sabatini (New York University Medical Center) organisèrent au Cold Spring Harbor Laboratory (New York), un colloque sur le thème “Membrane Biogenesis”. A cette réunion, je présentais notre travail avec Maurice Wibo, Danièle Godelaine et Denise Thines-Sempoux – qui sera publié deux ans plus tard. L’homogénéisation du tissu hépatique provoque la fragmentation de la membrane plasmique : la moitié des fragments – les plus grands – sédimentent avec les noyaux ; l’autre moitié, ceux dérivant de la membrane en contact avec l’espace de Disse et le plasma sanguin, sédimentent dans les microsomes. Après équilibration des microsomes en gradient de saccharose, les enzymes marqueurs de la membrane plasmique (5’-nucléotidase, phosphatase alcaline, phosphodiestérase alcaline I) s’équilibrent à la densité 1,14, ou 1,17 s’il s’agit d’une préparation purifiée de membrane plasmique (qui contient davantage de jonctions serrées, plus riches en protéines et donc plus denses que la zone des villosités en contact avec le plasma). Nous avons montré que les fragments de membrane plasmique présentent deux propriétés singulières : en présence de digitonine, leur densité d’équilibre augmente (« digitonin shift») ; l’addition de cette saponine aux microsomes (une mole de saponine par mole de cholestérol) provoque une augmentation de la densité d’équilibre des marqueurs de ce groupe de 0,03 à 0,04 g.cm3. Les fragments de membrane plasmique traités à la digitonine présentent un aspect caractéristique. L’examen au microscope électronique permet de les distinguer des autres membranes par leur aspect « fenestré », probablement dû à des dépôts de complexe digitonine-cholestérol. Ces deux propriétés s’observent aussi bien avec les microsomes qu’avec des préparations purifiées de membrane plasmique. Si la 5’-nucléotidase et les autres enzymes de la membrane plasmique que l’on trouve dans des préparations purifiées de complexe de Golgi ou de membrane externe de mitochondries appartiennent vraiment à ces entités subcellulaires, ils ne devraient pas présenter de digitonin shift et l’on ne devrait pas trouver de fragments membranaires à l’aspect fenestré. Le fait que ces deux particularités se retrouvent dans ces préparations purifiées plaide en faveur d’une contamination par des fragments de membrane plasmique. Si cela n’avait pas été le cas et si le même enzyme (la 5’-nucléotidase, par exemple) avait appartenu à plus d’un type membranaire, il se comporterait de façon variable en fonction de la préparation membranaire analysée. Avec le même type d’approche utilisant un « perturbateur de densité », il fut possible de montrer que le reticulum endoplasmique ne renferme pas de 5’-nucléotidase. Dans ce cas, le perturbateur de densité n’était pas la digitonine mais le pyrophosphate (ou un chélateur de cations comme l’EDTA) qui détache les ribosomes liés aux vésicules microsomiales rugueuses dérivant du reticulum endoplasmique. Ce traitement provoquait un allègement significatif de ces vésicules, se traduisant par une densité d’équilibre moins élevée pour les marqueurs enzymatiques du reticulum (glucose 6-phosphatase, estérase, UDP glucuronosyltranférase), mais pas pour la 5’-nucléotidase. Le traitement des microsomes successivement par la digitonine et le pyrophosphate, provoquait une augmentation de la densité d’équilibre de la 5’nucléotodase et une diminution de celle de la glucose 6-phosphatase, excluant toute association de la 5’-nucléotidase au reticulum endoplasmique.
C’est peu de dire qu’à la fin de ma présentation la discussion fut animée. A titre d’illustration des divergences de point de vue, je cite dans Références le titre de l’exposé de Nica Borghese (C.N.R. Center of Cytopharmacology, University of Milan), dans lequel elle concluait à la présence de NADH cytochrome b5 reductase dans le reticulum endoplasmique, la membrane mitochondriale externe et le complexe de Golgi. Par contre, David Sabatini et Günter Blobel saisirent la signification de nos résultats dans l’optique de leur « hypothèse du signal » (Signal Hypothesis) proposée en 1971 : la liaison du ribosome à la membrane du reticulum endopasmique dépend de la présence d’un « signal » porté par le peptide en cours de synthèse. En d’autres termes, les polypeptides sont dotés d’une « adresse », d’un « code postal » stipulant leur destination finale dans ou hors de la cellule. Cela implique que la membrane de destination du polypeptide synthétisé – et elle seule – possède le récepteur ad hoc reconnaissant le signal. La notion de différence qualitative entre membranes de différents types était compatible avec cette hypothèse.
Références : Amar-Costesec A, Beaufay H, de Duve C The distribution of enzymes in subcellular membranes from rat liver (1979) Abstracts of papers presented at the meeting on Membrane biogenesis
Wibo M, Thinès-Sempoux D, Amar-Costesec A, Beaufay H, Godelaine D Analytical Study of Microsomes ans Isolated Subcellular Membranes from Rat Liver. VIII. Subfractionation of preparations enriched with plasma membranes outer mitochondrial membranes, or Golgi complex membranes (1981)
Borghese N, Meldolesi J Biogenesis and turnover of NADH cytochrome b5 reductase, a membrane protein with multiple localization in rat hepatocytes (1979) Abstracts of papers presented at the meeting on Membrane biogenesis
Thinès-Sempoux D, Amar-Costesec A, Beaufay H, Berthet J The Association of Cholesterol, 5’-Nucleotidase and Alkaline Phosphodiesterase I with a Distinct Group of Microsomal Particles (1969)
Amar-Costesec A, Wibo M, Thinès-Sempoux D, Beaufay H, Berthet J Analytical Study of Microsomes ans Isolated Subcellular Membranes from Rat Liver. IV. Biochemical, Physical and Morphological Modifications of Microsomal Components Induced by Digitonin, EDTA and Pyrophosphate (1974)
Hétérogénéité biochimique du reticulum endoplasmique
Le reticulum endoplasmique des hépatocytes est un vaste réseau membranaire (plusieurs m2 par g de foie) renfermant des centaines de protéines différentes (voir le tableau, en fin de chapitre, adapté de la revue publiée en 1989). Lorsque l’on centrifuge, des mitochondries, des lysosomes, ou des peroxysomes dans un gradient de saccharose, jusqu’à l’équilibre isopycnique, tous les constituants de ces organites présentent des profils de distribution de densité semblables. On aurait pu s’attendre à ce qu’il en soit de même pour le réticulum : ce n’est pas le cas. Avec Henri Beaufay, nous avons montré que ces enzymes se distribuent selon trois modes : (i) le profil de distribution des flavoprotéines – NADH cytochrome b5 et NADPH cytochrome P-450 réductases – et des cytochromes présente un pic à la densité 1,14, correspondant à la densité modale des vésicules lisses issues de la fragmentation du reticulum pendant le broyage des tissus ; (ii) celui de l’ARN ribosomial présente un pic à la densité 1,23 ; John A. Todd et Eugene Marcantonio (Department of Cell Biology, New York University School of Medicine) ont montré que ce mode de distribution était aussi celui des ribophorines (oligosaccharyl-transférase), et Bernard Dublet (International Institute of Cellular and Molecular Pathology, Bruxelles), celui du récepteur de la particule de reconnaissance du signal et de la peptidase du signal ; (iii) la glucose 6-phosphatase, l’UDP glucuronosyl transférase et les estérases se répartissent de manière assez uniforme le long du gradient, des densités 1,10 à 1,25. En 1971, Le fait que les vésicules dérivant du reticulum se distribuent selon un large éventail de densités traduit leur « caractère polydisperse » ; Maurice Wibo (International Institute of Cellular and Molecular Pathology, Bruxelles) a établi que cette caractéristique s’explique par leur charge en ribosomes : les fractions de faible densité renferment les vésicules lisses ; les fractions de densité élevée contiennent des vésicules à forte charge en ribosomes ; entre les deux, existe un spectre continu de vésicules dont la densité d’équilibre croît proportionnellement à la charge en ribosomes. Glucose 6-phosphatase et NADPH-cytochrome c réductase sont présentes dans les vésicules lisses et dans les vésicules rugueuses.
Références : Amar-Costesec A Reticulum endoplasmique: anatomie d’une membrane biologique (1989)
Beaufay H, Amar-Costesec A, Thinès-Sempoux D, Wibo M, Robbi M, Berthet J Analytical Study of Microsomes and Isolated Subcellular Membranes from Rat Liver. III. Subfractionation of the Microsomal Fraction by Isopycnic and Differential Centrifugation in Density Gradients (1974)
Amar-Costesec A, Todd JA, Kreibich G Segregation of the Polypeptide Translocation Apparatus to Regions of the Endoplasmic Reticulum Containing Ribophorins and Ribosomes. I. Functional Tests on Rat Liver Microsomal Subfractions (1984)
Marcantonio EE, Amar-Costesec A, Kreibich G Segregation of the Polypeptide Translocation Apparatus to Regions of the Endoplasmic Reticulum Containing Ribophorins and Ribosomes. II. Rat Liver Microsomal Subfractions Contain Equimolar Amounts of Ribophorins and Ribosomes (1984)
Amar-Costesec A, Dublet B, Beaufay H Translocation and proteolytic processing of nascent secretory polypeptide chains: two functions associated with the ribosomal domain of the endoplasmic reticulum (1989)
Wibo M, Amar-Costesec A, Berthet J, Beaufay H Electron Microscope Examination of Subcellular Fractions. III. Quantitative Analysis of the Microsomal Fraction Isolated from Rat Liver (1971)
Il y a deux interprétations possibles au fait que les constituants du reticulum présentent des profils de distribution différents : (i) il existe deux réseaux membranaires, l’un portant les chaînes de transport d’électrons et l’autre, la glucose 6-phosphatase. Cette hypothèse de la multiplicité fut écartée à la lumière d’observations au microscope électronique : (i) Stanley Fowler et José Remacle montrèrent que des anticorps hybrides anti-cytochrome b5– anti-ferritine marqués à la ferritine décorent toutes les vésicules microsomiales ; (ii) A. Leskes (The Rockefeller University), a montré que le dépôt de phosphate de plomb produit par la réaction cytochimique de la glucose 6-phosphatase sur le glucose 6-phosphate est réparti sur tout le reticulum ; (iii) Shiro Matsuura (Department of Physiology, Kansaï Medical University, Osaka) a montré que des anticorps anti-cytochrome P-450 conjugués à la ferritine décorent toutes les vésicules microsomiales ; (iv) Tsuneo Morimoto a montré que des anticorps anti-NADPH cytochrome c réductase conjugués à la ferritine marquent la surface externe de tout le réticulum endoplasmique. L’hypothèse de l’unicité du reticulum était validée ; la composition biochimique et enzymatique des vésicules lisses et rugueuses issues de la fragmentation du reticulum est qualitativement mais pas quantitativement la même.
Références : Remacle J, Fowler S, Beaufay H, Amar-Costesec A, Berthet J Analytical Study of Microsomes and Isolated Subcellular Membranes from Rat Liver. V. electron microscope examination of microsomes for cytochrome b5 by means of a ferritin-labeled antibody (1976)
Leskes A, Siekevitz P, Palade G Differentiation of endoplasmic reticulum in hepatocytes II. Glucose-6-phosphatase in Rough Microsomes (1971)
Matsuura S, Fujii-Kuriyama Y, Tashiro Y Immunoelectron microscope localization of cytochrome P-450 on microsomes and other membrane structure (1978)
Morimoto T, Matsuura S, Sazaki S, Tashiro Y, Omura T Immunochemical and immunoelectron microscope studies on the localization of NADPH-cytochrome c reductase (1976)
Étant établi que le reticulum endoplasmique des hépatocytes est unique, il fallait trouver une explication à son hétérogénéité biochimique établie par (i) nos expériences de centrifugation isopycnique ; (ii) des résultats de centrifugation différentielle en gradient de densité ; (iii) des expériences de solubilisation différentielle des constituants microsomiaux par la digitonine ; (iv) la mesure des taux de renouvellement (turn over) individuels des protéines du réticulum. En 1981, j’ai formulé une hypothèse sur la distribution latérale des enzymes du réticulum, c’est-à-dire sur leur répartition entre portions lisses et rugueuses. Le fait que les différences de distribution en gradient de densité soient quantitatives et non qualitatives révélait une hétérogénéité organisée de la face cytosolique de la membrane : elle serait un mélange de constituants du domaine ribosomial (complexes supramoléculaires de ribosomes et de la machinerie de translocation des protéines à travers la membrane) et de constituants du domaine lisse ; les deux chaînes de transport d’électrons de ce domaine formeraient des complexes protéiques oligomériques distincts, comme l’ont suggéré Lars Ernster et ses associés (Wenner-Gren Institute, Stockholm Universitet). Ils ont tenté d’en faire la démonstration en fragmentant les microsomes rugueux par traitement aux ultrasons, et en séparant des fragments de compositions biochimiques différentes. Les complexes de flavoprotéines et de cytochromes ont été observés au microscope électronique par Shiro Matsuura et par Tsuneo Morimoto, cités ci-dessus. Ces résultats nous ont conduit à proposer dans notre article de 1981 une représentation en “ peau de léopard” pour la face cytosolique de la membrane du reticulum, avec des taches noires (le domaine ribosomial) sur fond clair (le domaine lisse des oxydoréductases).
Références : Amar-Costesec A, Beaufay H A structural basis of enzymic heterogeneity within liver endoplasmic reticulum (1981)
Beaufay H, Amar-Costesec A, de Duve C The topology of enzymes in microsomes from liver (1981)
Eriksson LC, Bergstrand A, Dallner G Lateral enzyme topology in the rough endoplasmic reticulum of rat liver (1977)
Dallman PR, Dallner G, Bergstrand A, Ernster L Heterogeneous Distribution of Enzymes in Submicrosomal Membrane Fragments (1969)
Oxygénases microsomiales
Très tôt après leur découverte, les microsomes furent associés à la synthèse protéique. A la fin des années 1940, Christian de Duve (International Institute of Cellular and Molecular Pathology, Bruxelles) identifia, en 1949, le premier enzyme microsomial sans rapport avec ce processus, la glucose 6-phosphatase. Les propriétés cinétiques et la localisation de l’enzyme furent étudiées par Henri Géry Hers et Henri Beaufay. Depuis cette découverte, plusieurs centaines d’enzymes microsomiaux ont été répertoriés (voir le Tableau à la fin du chapitre). La synthèse des chaînes glycaniques des glycoprotéines et des glycolipides met en jeu la coopération du réticulum endoplasmique et du complexe de Golgi, deux composants qui sédimentent dans les microsomes. La métabolisation et l’élimination des « xénobiotiques » est présente sous une forme plus ou moins élaborée dans pratiquement toutes les cellules, des bactéries aux mammifères. On désigne sous le nom de xénobiotique toute substance étrangère à l’organisme, introduite volontairement ou accidentellement dans l’organisme, par voie orale, pulmonaire ou cutanée : polluants atmosphériques, colorants, additifs alimentaires, substances médicamenteuses, hydrocarbures polycycliques cancérigènes, pesticides… La plupart de ces molécules ont un caractère hydrophobe. En l’absence d’un mécanisme physiologique d’élimination efficace, ces substances s’accumulent dans les tissus adipeux de l’organisme, ce qui explique leur dangerosité potentielle pour la santé. Après la Seconde Guerre mondiale, des taux anormalement élevés d’un pesticide largement utilisé à l’époque, le dichlorodiphényltrichloroéthane (DDT) ont été retrouvés dans le système nerveux central de patients décédés. L’usage intensif du DDT fut dénoncé par la biologiste Rachel Carson dans son célèbre ouvrage « Silent Spring », publié en 1962. Elle y décrivait les effets nocifs des pesticides sur les populations d’oiseaux. Cette dénonciation, à l’origine du mouvement écologiste, amena des restrictions sévères à l’emploi du DDT, et jusqu’à son interdiction.
Gerald C. Mueller, dans le laboratoire de James A. Miller et d’Elizabeth C. Miller (McArdle Memorial Laboratory, The University of Wisconsin), découvrit que le foie joue un rôle dans le métabolisme du DAB (N,N-Diméthyl-4-AminoazoBenzène). On soupçonnait ce colorant aminoazoïque de se lier à des protéines cellulaire et d’être cancérigène, alors qu’à l’époque il était utilisé dans l’alimentation sous le nom de « jaune de beurre » ! Mueller et Miller montrèrent qu’une fraction particulaire, préparée à partir d’un homogénat de foie de rat, catalyse la N-déméthylation (l’enlèvement d’un groupe méthyle CH3- lié à un atome d’azote) du DAB en présence d’oxygène et d’un nucléotide pyridinique réduit, le NADPH. Dans les années 1950, Julius Axelrod, sous la supervision de Bernard B. Brodie (Laboratory of Chemical Pharmacology, National Institutes of Health), élucida le mécanisme physiologique de transformation de l’acétanilide en aniline. L’acétanilide, présent dans un médicament très populaire, le Bromo Seltzer, prescrit aux patients souffrant de brûlures gastriques, provoquait une méthémoglobinémie ; la méthémoglobine est un produit d’oxydation de l’hémoglobine dont l’atome de fer ferreux (Fe2+) a été transformé en fer ferrique (Fe3+). Axelrod est surtout connu pour ses travaux sur les neurotransmetteurs de la famille des catécholamines, comme l’adrénaline ou la noradrénaline, travaux pour lesquels il reçut le prix Nobel médecine ou physiologie en 1970. Il débuta sa carrière comme postier avant de devenir technicien de laboratoire à New York University. Il s’intéressa aussi au métabolisme d’agents psychotropes : amphétamines et éphédrine et caractérisa les trois ingrédients indispensables à leur transformation : microsomes, TPNH et oxygène.
Références : Mueller GC, Miller JA The reductive cleavage of 4-dimethylaminoazobenzene by rat liver: The intracellular distribution of the enzyme system and its requirement for triphosphopyridine nucleotide (1949)
Brodie BB, Axelrod J The estimation of acetanilide and its metabolic products, aniline, N-acetyl p-aminophenol and p-amino-phenol, free and total conjugated, in biological fluids and tissues (1948)
La présence de transporteurs d’électrons fut mise en évidence par Kenneh J. Ryan et Lewis Engel; ils montrèrent que les microsomes de la glande corticosurrénale de bœuf catalysent l’hydroxylation d’une hormone, la progestérone, en présence de TPNH (NADPH) et d’oxygène. La réaction était inhibée par le monoxyde de carbone. En 1962, Tsuneo Omura et Ryo Sato (Osaka University Institute for Protein Research) découvrirent un nouveau cytochrome (le futur cytochrome P450). Ronald W. Estabrook (University of Texas Southwestern Medical Center) montra son implication dans la réaction étudiée par Ryan et Engel et sa fonction de mono-oxygénase. Les « oxydases à fonction mixte » microsomiales catabolisent un cancérigène, le DAB, un médicament, l’acétanilide, ou les stéroïdes, en scindant une molécule d’O2 en deux atomes d’oxygène, dont l’un se fixe sur le substrat et l’autre se combine à l’eau pour former une molécule de peroxyde d’hydrogène, d’où le nom de « mono-oxygénases » par lequel on les désigne. Les substrats des mono-oxygénases présentent une grande diversité de structures moléculaires et d’hydrophobicité. A la fin des années 1950, des flavoprotéines et des cytochromes furent localisés dans les microsomes. En 1958, dans le laboratoire de Britton Chance (Johnson Foundation), le physicochimiste Martin Klingenberg et un étudiant postdoctoral, David Garfinkel (Harvard University), identifièrent dans les microsomes de foie de rat et de porc un pigment liant le monoxyde de carbone (CO). En 1964, Sato et Omura montrèrent qu’il s’agissait d’une hémoprotéine, avec un hème de type b. Ils proposèrent de l’appeler cytochrome P450, car le spectre différentiel du complexe entre le CO et le pigment réduit présente un pic d’absorption à 450 nm. Ce nom fut adopté malgré sa non-conformité avec la nomenclature des cytochromes et leur classement en quatre groupes : a, b, c et d, selon la nature de l’hème du groupement prosthétique.
Références : Ryan KJ, Engel LL Hydroxylation of steroids at carbon 21 (1957)
Omura T, Sato R A new cytochrome in liver microsomes (1962)
Estabrook RW, Cooper DY, Rosenthal O The light reversible carbon monoxide inhibition of the steroid C21-hydroxylase system of the adrenal cortex (1963)
Klingenberg M Pigments of rat liver microsomes (1958)
Garfinkel D Studies on pig liver microsomes. I. Enzymic and pigment composition of different microsomal fractions (1958)
Omura T, Sato R The carbon monoxide-binding pigment of liver microsomes. I. Evidence for its hemoprotein nature (1964)
Les flavoprotéines sont des transporteurs d’électrons contenant un ou deux coenzymes dont la structure est apparentée à celle de la riboflavine (vitamine B2). Les flavoprotéines transfèrent généralement des électrons à des cytochromes. L’existence de flavoprotéines mitochondriales était connue : en 1949, George Hogeboom avait montré, en fractionnant par centrifugation différentielle des homogénats de foie de rat, de foie de souris ou d’hépatome murin, qu’une flavoprotéine, la DPNH cytochrome c réductase, est localisée dans les microsomes. La même année, Bernard L. Horecker (National Institute of Health), le découvreur de la voie des pentoses phosphate, caractérisa une TPNH cytochrome c réductase. George Hogeboom et Walter Schneider, anciens collaborateurs d’Albert Claude et pionniers de la localisation subcellulaire des enzymes par centrifugation différentielle, montrèrent que la proportion de TPNH cytochrome c réductase présente dans les microsomes est plus élevée que celle de DPNH cytochrome c réductase. Après les flavoprotéines, ce fut au tour des cytochromes : Charles F. Strittmatter et Eric Glendinning Ball (Department of Biological Chemistry, Harvard Medical School, Boston) rapportèrent la présence d’une hémoprotéine, le cytochrome m, dans les microsomes hépatiques. Ce cytochrome n’était pas inconnu ; il avait été identifié par David Keilin et E.F. Hartree (Molteno Institute for Research in Parasitology, University of Cambridge, UK)), en 1940, et appelé cytochrome b1. Alwyn M. Pappenheimer et Carroll M. Williams (Department of Bacteriology, New York University School of Medicine) le baptisèrent cytochrome b5. En 1956, Philipp Strittmatter et Sidney F. Velick (Department of Biological Chemistry, Washington University School of Medicine, St. Louis) isolèrent à partir de foie de lapin un enzyme catalysant le transfert d’électrons du diphosphopyridine nucléotide réduit (DPNH, NADH) à un cytochrome microsomial, puis au cytochrome c. Les pièces du puzzle s’assemblèrent : les deux chaînes microsomiales de transport d’électrons sont composées chacune d’une flavoprotéine réductase et de cytochromes : (i) NADH : cytochrome b5 oxydoréductase et (ferri)cytochrome b5 (ii) NADPH : cytochrome P450 oxydoréductase et cytochrome P450 (il en existe une variété ; voir ci-dessous) ; l’oxydoréductase renferme une molécule de flavine adénine dinucléotide (FAD) et une molécule de flavine adénine mononucléotide (FMN). Les électrons suivent le trajet :
La cytochrome P-450 réductase fournit des électrons à quatre voies métaboliques : (i) celle des cytochromes P450, une superfamille d’hémoprotéines comprenant plus de deux mille membres impliqués dans le métabolisme des xénobiotiques (contaminants et cancérigènes chimiques, pesticides) et des médicaments, et dans la synthèse d’endobiotiques (stérols, acides biliaires) ; (ii) celle du cytochrome b5 et des désaturases et élongases impliquées dans la transformation des acides gras ; (iii) aux enzymes de la biosynthèse des stérols (7 déhydrocholestérol réductase, squalène mono-oxygénase, cytochrome b5) ; (iv) celle de l’hème oxygénase, qui catalyse les étapes finale du catabolisme de l’hème chez les mammifères. Le catabolisme des xénobiotiques comporte deux phases : au cours de la phase I (phase d’oxydation), des substrats hydrophobes sont transformés en molécules polaires par les mono-oxygénases ; au cours de la phase II (phase de conjugaison) les produits d’oxydation sont conjugués par une liaison covalente à des molécules facilitant leur excrétion par le rein. On classe parmi les enzymes de la phase I l’époxyde hydrolase (les époxydes sont des molécules très réactives susceptibles d’endommager les constituants cellulaires comme les acides nucléiques). Parmi les enzymes de la phase II, on trouve l’UDP-glucuronosyl transférase qui conjugue la bilirubine à une molécule d’acide glucuronique. La bilirubine est un métabolite naturel, mais son accumulation dans l’organisme a des effets néfastes (jaunisse). La déficience en bilirubine glucuronosyltransférase est à l’origine de la maladie de Gilbert (déficit partiel) ou de la maladie de Crigler-Najjar (déficit total), une maladie très rare à transmission autosomique récessive. Un autre enzyme de la phase II, la sulfotransférase, catalyse le transfert d’un groupe sulfate sur un groupe alcool ou aminé d’un accepteur (un stéroïde, par exemple). Le donneur de sulfate est le 3’-phosphoadénosine 5’-phosphosulfate (PAPS).
La NADH cytochrome b5 réductase est une flavoprotéine à FAD, qui transmet les électrons du NADH à un transporteur ubiquitaire, le cytochrome b5. C’est un enzyme membranaire dont le site actif est orienté vers le cytosol. Il en existe une forme « soluble » dans les hématies : la NADH méthémoglobine réductase, qui catalyse la réduction de la méthémoglobine ; ce produit d’oxydation de l’hémoglobine est incapable de fixer l’oxygène et, donc, de le transporter vers les tissus. La méthémoglobinémie héréditaire est une pathologie provoquée par la déficience génétique (autosomique récessive) en NADH cytochrome b5 réductase. Cette maladie génétique rare affecte les globules rouges et se traduit, à la naissance, par une cyanose par déficit du transport de l’oxygène.
La stéaroyl CoA désaturase (Δ-9 désaturase) est une oxydoréductase microsomiale qui transforme l’acide stéarique – un acide gras saturé – en acide oléique. La stéaroyl CoA désaturase reçoit ses électrons du cytochrome b5 et introduit une double liaison dans la chaîne aliphatique de l’acide stéarique. Cette réaction de désaturation C9-C10 est une étape limitante de la biosynthèse des acides gras insaturés, une des fonctions importantes du reticulum endoplasmique. L’importance de la stéaroyl CoA désaturase comme régulateur du métabolisme et son rôle dans l’apparition du « syndrome métabolique », dont l’obésité est une manifestation préoccupante, a été longtemps méconnue.
Références : Hogeboom GH Cytochemical studies of mammalian tissues. II. The distribution of diphosphopyridine nucleotide-cytochrome c reductase in rat liver fractions (1949)
Horecker BL, Heppel LA The reduction of cytochrome c by xanthine oxidase (1949)
Hogeboom GH, Schneider WC Cytochemical studies of mammalian tissues. III. Isocitric dehydrogenase and triphosphopyridine nucleotide-cytochrome c reductase of mouse liver (1950)
Strittmatter CF, Ball EG A Hemochromogen Component of Liver Microsomes (1952)
Pappenheimer AM, Williams CM Cytochrome b5 and the dihydro-coenzyme I-oxidase system in the cecropia silkworm (1954)
Strittmatter P, Velick SF A Microsomal Cytochrome Reductase Specific for Diphosphopyridine Nucleotide (1955)
Fonctions et constituants du reticulum endoplasmique hépatique
| Biosynthèse des protéine du reticulum endoplasmique (membrane et réticuloplasme), des lysosomes, du complexe de Golgi, de la membrane plasmique, et des protéines sécrétoires |
|---|
| Récepteur de la particule de reconnaissance du signal; complexe de translocation (translocon, hétérotrimère Sec61); chaperone Bip; peptidase du signal |
| Chaperones GRP (Glucose-regulated protein); protéine disulfure isomérase; protéine de choc thermique 70 kDa 5; calnexine; calréticuline; ERp57 (Endoplasmic Reticulum protein 57kDa); peptidyl-prolyl cis/trans isomérase |
| Biosynthèse et modifications des chaînes oligosaccharidiques et glycosylation des protéines |
| N-acétylglucosamine-phosphotransférase ; N-acétylglucosamine-transférase ; mannosyl-transférase ; glucosyl-transférase ; Oligosaccharyl-tranférase (ribophorines I et II) |
| glucosidase II; mannosidases |
| Métabolisme des lipides, des glycérophospholipides, du cholestérol et du plasmalogène |
| NADH cytochrome b5 réductase (désaturation et élongation des acides gras) |
| glycérophosphate (dihydroxyacétone phosphate) acyltransférase ; acide lysophosphatidique acyltransférase |
| stéroïde aromatase (œstrogène synthase)… |
| Métabolisme du glycogène |
| Glucose 6-phosphatase ; transporteur du glucose 6-phosphate (T1) ; transporteur du glucose (T2) |
| transporteur du phosphate (T3) |
| Métabolisme des médicaments, des vitamines liposolubles, des xénobiotiques et des acides gras polyinsaturés |
| NADPH cytochrome P-450 réductase; cytochromes P-450 |
| NADH cytochrome b5 réductase |
| Catabolisme de l’hémoglobine |
| Hème oxygénase |
| Métabolisme de la bilirubine |
| UDP glucuronosyltransférase |
| Stockage et régulation du Ca2+ intracellulaire. |
| Récepteur de l’inositol tri phosphate |
| Carboxylestérases (hydrolases A et B) |